从一个病例说起:NGS在肌萎缩侧索硬化(ALS)诊断中的应用
感谢顾卫红教授和樊东升教授在本文撰写过程中给予的指导和支持。
一
关于ALS
对于ALS(amyotrophic lateral sclerosis,肌萎缩侧索硬化),可能很多人并不熟悉,但是一提到伟大的理论物理学家霍金,大家一定不陌生。霍金应该是全球最知名的ALS患者,他于21岁确诊为ALS,一直活到76岁,远远超过了ALS患者5年的存活期。后来,标志性的动作、挂满高科技附件的轮椅、电子合成器发出的语音等成为了一种象征。
在2014年,由美国波士顿学院前棒球选手发起的ALS冰桶挑战风靡全球,各界大佬纷纷挑战。其旨在让更多人知道被称为渐冻人的罕见疾病,同时也达到募款帮助治疗的目的。国内包括雷军、周杰伦和王石等各界大佬纷纷响应。
而这个ALS到底是什么病呢?
运动神经元病是一种病因未明、主要累及大脑皮质、脑干和脊髓运动神经元的神经系统变性疾病,包括肌萎缩侧索硬化(amyotrophiclateral sclerosis, ALS)、进行性肌萎缩、进行性延髓麻痹和原发性侧索硬化4种临床类型。
ALS是运动神经元病中最常见的类型,一般中老年发病多见,以进行性加重的骨骼肌无力、萎缩、肌束颤动、延髓麻痹和锥体束征为主要临床表现,生存期通常为3-5年。
根据GeneReviews(权威遗传病相关临床信息资源库,由多位专家撰写并经过严格的编辑和评审程序所在线发表的数据库)里的描述:

ALS的诊断基于临床特征,电诊断测试以及排除具有相关症状的其它健康状况。分子遗传学检测在ALS的遗传亚型和遗传咨询的诊断中发挥着重要作用。
个案介绍
66岁男性患者于十余年前发现双手肌肉萎缩,缓慢进展,上肢近端及下肢无明显异常。通过查体,发现双手大小鱼际肌和骨间肌萎缩,腱反射对称引出。此外,患者的舅舅及大哥也有类似表现,疾病后期出现吞咽困难。
查体检查结果
双手大小鱼际肌和骨间肌萎缩,腱反射对称引出。

考虑到患者家族中有ALS的家族史,为了进一步明确诊断,因此送检赛福基因进行全外显子组测序。结果如下:
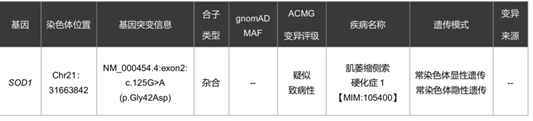
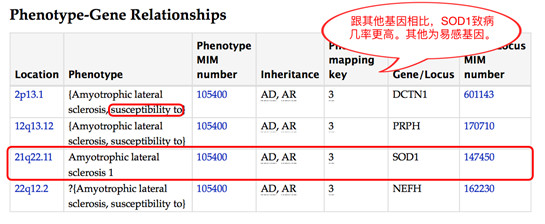
患者检测到了SOD1基因的一个错义突变,而SOD1正是肌萎缩侧索硬化症1型的致病基因,并且如手部小肌肉萎缩、肌无力、肌萎缩和吞咽困难等症状也与患者或家族史相符。下图为OMIM中,表型与基因之间的关联。
在致病性判读中,因该变异位于超氧化物歧化酶铜/锌结合结构域(PM1),错义突变是造成疾病的主要原因(PP2),在ExAC、gnomAD等数据库中的发生频率没有收录(PM2),多个蛋白预测软件预测该变异有害(PP3)。该变异在ClinVar里有1次提交,被定义为致病性(PP5)。HGMD中也有文献报道该位点有害。根据《ACMG遗传变异分类标准与指南》,该变异符合”疑似致病性变异“:PM1+PM2+PP2+PP3+PP5。
并且该病少数情况下可以表现为常染色体隐性遗传,大多数情况下为常染色体显性遗传,存在外显不全的情况。1995年,de Belleroche等报道该病的外显率约为80%。在这个案例中,因母亲情况未知,如果考虑母亲外显不全或症状极其轻微,该家系符合常染色体显性遗传,患者的合子类型可以解释其患病的遗传模式。
此外,我们对患者的两个姨妈(U1、U2)、三个兄弟(S1、S2、S3)、两个儿子(B1、B2)以及一个侄子(O)进行了目标突变的一代验证,希望可以发现SOD1突变导致的ALS I型的特殊性。
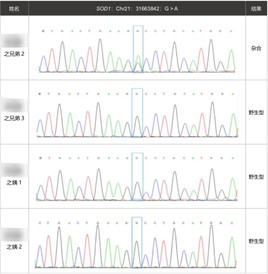
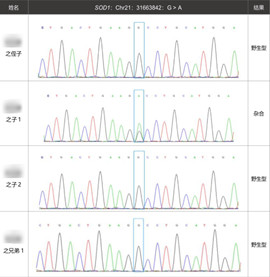
根据结果,我们绘制了如下的家系图:

通过家系图和一代验证结果,我们很意外地发现,患者的四弟(S2)以及大儿子(B1)也是同样的基因型,但是四弟并没有表现相应的临床表型,而根据病例信息,先证者39岁的大儿子于5-6年前出现右手手抖,空手、拿筷子、端酒杯均发生过手抖现象,但并不影响正常生活的情况。SOD1的这个突变究竟在这个家族中扮演了什么角色呢?
二
进一步讨论
SOD1这个基因编码超氧化物歧化酶1,是重要的细胞质抗氧化酶,可以将超氧化物自由基代谢为分子氧和过氧化氢,从而起到防止氧中毒的作用。
在中国学者去年发表的一篇中国人群SOD1突变谱的研究中,我们这个案例中发现的患者c.125G>A的突变类型也被首次报道。
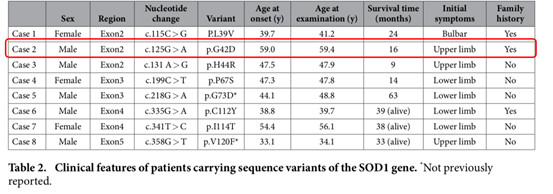
并且在该文章的讨论部分也就因SOD1突变导致的ALS存在异质性很强,表型和进展在不同患者中都有不同表现的情况做了进一步讨论。

上图红框部分文字为研究者列举的一些患者表现型各异的情况,如G41D、P66S和I113T这三种突变类型分别导致了不同的临床表现型。

在该文的最后一段,研究者也对SOD1突变导致ALS患者的临床异质性做出假设,提出疾病的表型和发展可能受到表观遗传因素如性别、修饰基因、环境因素以及其它未知因素等共同影响。
由此,我们可以联想到是否由于SOD1基因的外显不全才导致临床表型异质性的现象呢?查阅大量相关文献后,我们发现SOD1基因确实有外显不全的案例报道,最出名的就是D90A这个变异类型,此前有过常染色体显性或常染色体隐性遗传模式的报道。报道发现D90A纯合突变致病的家系,并且将SOD1酶活性的丧失视为一种病理机制,但是有些隐性模式的单体型中存在修饰基因会降低SOD1突变体蛋白的毒性。早在2009年,加拿大学者就对SOD1的G27/P28不完全外显做过研究。研究者招募了12名菲律宾裔的ALS家族的成员,对先证者的SOD1进行测序,并且通过实时PCR和免疫印迹评估SOD1的表达。
研究结果发现,先证者2号外显子上的G27/P28的6bp小片段缺失突变是菲律宾人群中最常见的致病突变,而其低外显率可以解释为这个突变增加了SOD1 2号外显子mRNA原本就存在的可变剪接体的表达,导致突变等位基因的表达量减少,这一结果通过免疫组化实验进行了验证。
在这个大家系中,先证者的父母同时携带了G27/P28突变(del),但是因为该突变增强了SOD1 mRNA的2号外显子的天然存在的可变剪接,导致突变等位基因的转录减少。
我们看到,在加拿大研究者的案例中,一个家系中也存在携带的突变相同,但是父亲患病、母亲正常的情况,这一现象是不是跟上下游的SNP多态性位点相关或是另一条正常的基因上的多态性相关呢?
下图为G27/P28突变(del)的菲律宾家族的谱系图。【星号表示获得DNA样本和基因型的12个个体。ALS表型的个体为黑色标记,箭头处为先证者,斜线表示已故。单体型分析的标记显示在左侧,对先证者和其父母做了单体型分析。】
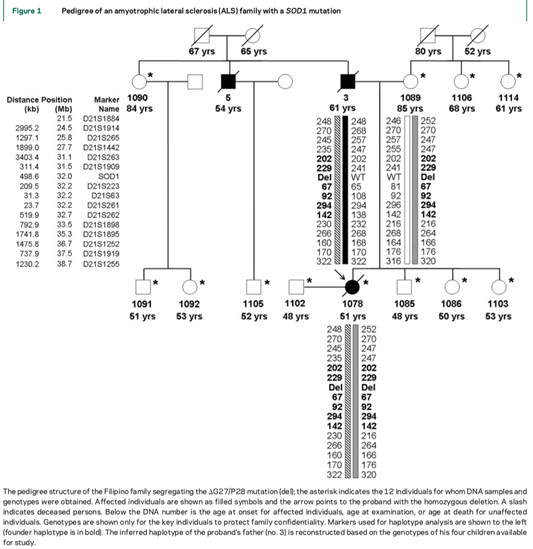
以此类推,在我们的案例中,是不是也存在这样的一个增强或削弱作用导致同一个突变类型的携带者有着不一样的表型呢?我们是否可以发现导致SOD1外显不全的另一种机理?
三
一些具体的建议
我们对ALS患者及其家庭有如下建议:
确诊后的治疗
根据GeneReviews中的建议,患者可以服用利鲁唑来对ALS进行治疗;如有延髓症状,使用三环类抗抑郁药和抗胆碱能药来减少口腔分泌物,从而减少抽吸的需要;使用抗抑郁药如Nuedexta(右美沙和奎尼丁)来控制假性延髓的影响;服用巴氯芬和苯二氮卓类药物减轻痉挛和肌肉痉挛。
患者儿子的风险评估和相关监控
因患者儿子的基因型与患者基因型一致,患者的儿子需要每隔一段时间进行一次专门的多学科ALS临床评估,如神经系统检查、肺功能检查等,以确保早发现早干预,提高患病时期的生活质量。
产前诊断
若与患者相同基因型的儿子要养育下一代,可通过产前诊断来避免携带者或者患儿的诞生。详情见下图中GeneReviews给出的产前诊断意见。

四
结语
2018年5月22日,国家卫生健康委员会、科技部、工业和信息化部、国家药品监督管理局、国家中医药管理局等五部门联合发布了第一批罕见病目录,共涉及121种疾病,ALS(肌萎缩侧索硬化)就在其中。ALS固然可怕,但是通过分子诊断的方法来早期确诊并采用科学的干预和治疗措施或可在很大程度上提高患者的生活质量,延长患者寿命。更重要的是,在ALS患者家庭中,通过分子诊断和产前诊断的方法,可尽量避免这个罕见遗传病在家族中传递,最大可能的缓解ALS对患者及其家庭的困扰。
参考资料:
1、AdamMP, Ardinger HH, Pagon RA, et al., editors. GeneReviews® [Internet]. Seattle(WA): University of Washington, Seattle; 1993-2018. Available from:https://www.ncbi.nlm.nih.gov/books/NBK1116/
2、OnlineMendelian Inheritance in Man, OMIM®. McKusick-Nathans Institute of GeneticMedicine, Johns Hopkins University (Baltimore, MD), {2018}. World Wide WebURL: https://omim.org/
3、Zinman,L., H. N. Liu, C. Sato, Y. Wakutani, A. F. Marvelle, D. Moreno, K. E. Morrison,et al. “A Mechanism for Low Penetrance in an ALS Family with a Novel SOD1Deletion.” Neurology 72, no. 13 (March 31, 2009): 1153–59.
4、Wei,QianQian, QingQing Zhou, YongPing Chen, RuWeiOu, Bei Cao, YaQian Xu, Jing Yang,and Hui-Fang Shang. “Analysis of SOD1 Mutations in a Chinese Population withAmyotrophic Lateral Sclerosis: A Case-Control Study and Literature Review.”Scientific Reports 7, no. 1 (December 2017). https://doi.org/10.1038/srep44606.


