《Cell》多组学研究揭示肠道菌群与自闭症的关系
自闭症谱系障碍(autism spectrum disorders,ASD)也称广泛性发育障碍或孤独症,被定义为以社会交往和沟通障碍、兴趣范围狭窄及重复刻板行为为主要特征的发育障碍[1]。ASD已经成为世界范围内最严重的神经发育障碍之一,平均每150名儿童就有一人患病,且发病率还在不断攀升[2]。ASD发病原因复杂,是遗传与外部环境相互作用引起的疾病[3]。近年来,关于肠道菌群对疾病的影响逐渐被研究者重视。有研究发现,ASD患者的肠道微生物失衡,细菌和真菌群构成及比例发生改变[4][5]。
2019年5月30日,Cell杂志发表文章《Human Gut Microbiota from Autism Spectrum Disorder Promote Behavioral Symptoms in Mice》,研究者将ASD患者与正常人(TD)的肠道菌群移植到无菌小鼠中,发现前者会诱导小鼠出现典型的自闭症表现,还会导致小鼠大脑中自闭症相关基因的表达以及可变剪接出现异常。研究还发现部分代谢产物可明显改善自闭症小鼠的行为学异常并调节小鼠大脑的神经兴奋性。
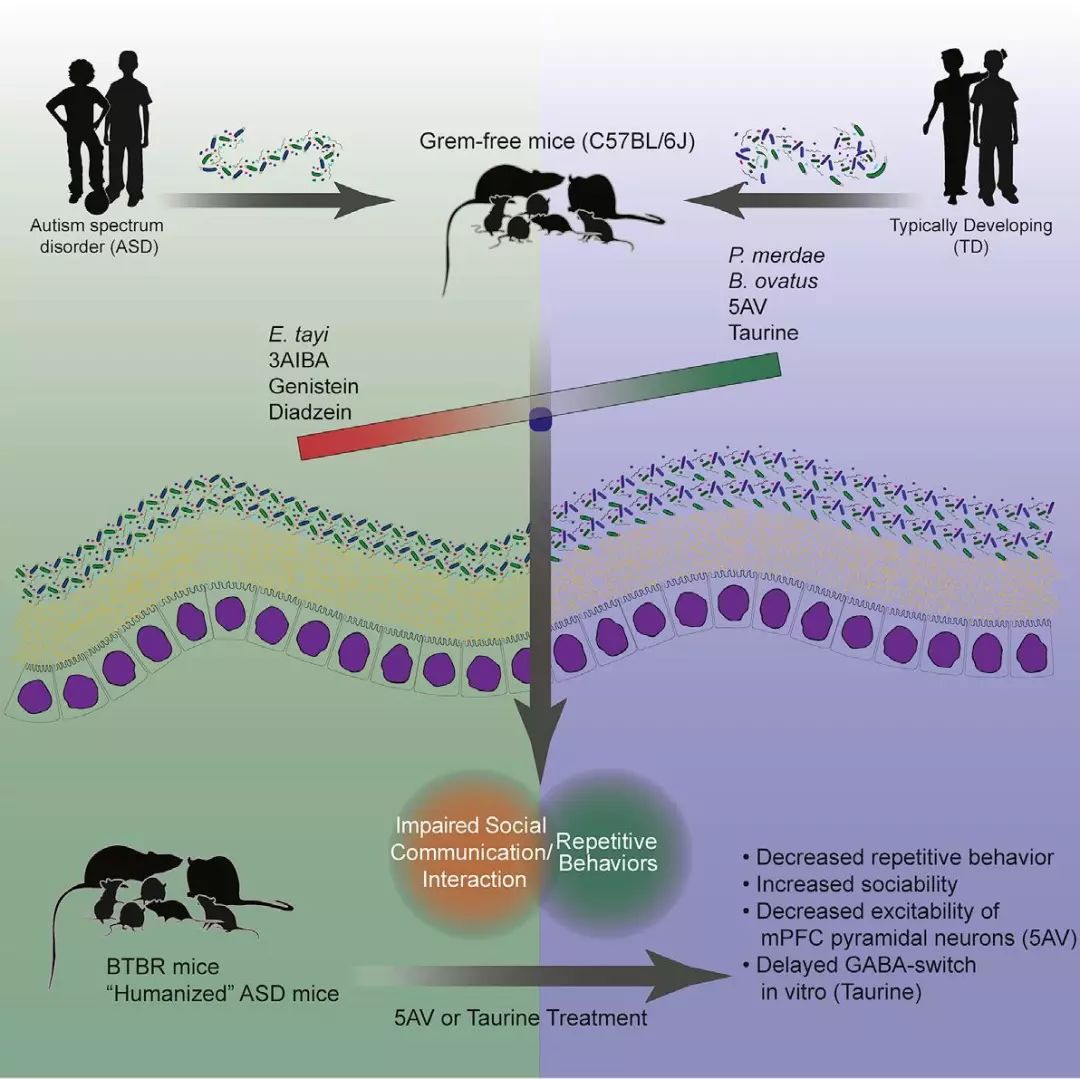
图1 实验流程:ASD与TD的肠道菌群移植、行为学观察研究、机制分析研究
行为学研究
在实验中,运用direct social interaction test(DSI)指标来评估ASD小鼠(接种了人类ASD患者肠道菌群的无菌小鼠)与TD小鼠(正常对照组)的行为,与TD小鼠相比,ASD小鼠表现为重复性行为增加,社交能力下降,运动能力下降,其中雄性小鼠的表现更为明显。由此可见肠道菌群可能是小鼠的自闭症表现的重要因素。
宏基因组学研究
研究者后续对自闭症患者的肠道菌群、移植小鼠及其子代的肠道菌群进行了宏基因组学分析,发现自闭症患者及ASD小鼠的肠道菌群与对照组存在明显差异。其中,正常个体/小鼠中卵圆形拟杆菌(Bacteroides ovatus)和粪副拟杆菌(Parabacteroides merdae)有明显富集;而自闭症个体/小鼠中毛螺菌科的菌种(Lachnospiraceae)则明显多于对照组(图2)。随后的相关性分析指出,卵圆形拟杆菌和粪副拟杆菌与重复性行为的减少及社交行为的增加呈正相关;而毛螺菌科的菌种则恰好相反。研究者认为该发现支持特定细菌可能导致各种ASD症状的假设。

图2 ASD与TD相比,多个菌种存在差异性
转录组学研究
ASD的症状之一是出现社交障碍,而与之相关的大脑结构是大脑前额叶皮层(PFC)和纹状体(STR)。在对ASD与TD小鼠的转录组研究时发现除基因转录表达存在差异之外,ASD小鼠的基因的可变剪接也发生明显改变,这与自闭症患者大脑中基因可变剪接异常的表型相吻合;其中发生异常可变剪接的基因大多在神经元中高表达,且有52种基因是导致自闭症的重要候选基因。
图3 转录组学分析ASD与对照组差异表达基因
代谢组学研究
考虑到大脑中的基因表达、剪接和神经元功能可以由小分子代谢物随循环系统进行调节,研究者对ASD小鼠及其对照组的肠道/血液代谢组学进行了研究分析。结果发现ASD小鼠的肠道中有27种代谢产物发生明显变化,其中包含多种GABA受体及甘氨酸受体的激动剂/抑制剂,如GABA受体激动剂5-氨基戊酸(5AV)和牛磺酸在ASD小鼠中的水平明显减少,这与自闭症患者中的研究结果一致;此外,甘氨酸受体激动剂3AIBA和多种生物活性分子如类黄酮、三羟基异黄酮和大豆甙元在ASD小鼠中的水平却明显增加(图4)。
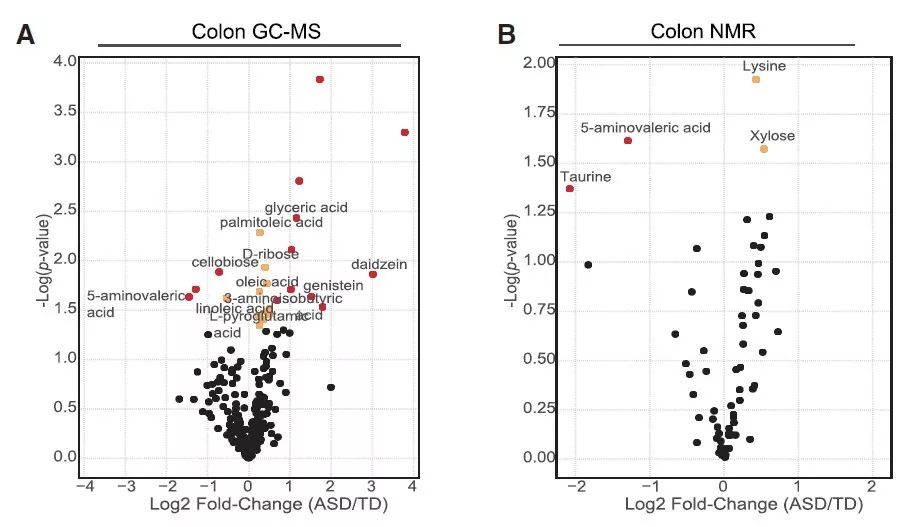
图4 通过气相色谱法-质谱(GC-MS)与核磁共振分析代谢组学变化
为了对5-氨基戊酸(5AV)和牛磺酸进一步研究,研究者设计分别对BTBR小鼠(有典型ASD行为的小鼠)进行5AV和牛磺酸的依赖性治疗研究,结果显示治疗后的BTBR小鼠重复性行为得到明显减少,社交性行为增多,表现出良好的治疗效果。此外,脑检查显示5AV尤其降低了小鼠脑神经兴奋性。
总结
本研究从实验组和对照组的行为学、宏基因组学、转录组学和代谢组学多个角度出发,充分研究肠道微生物与自闭症表型的直接关联性:特定菌群会改变肠道的代谢产物,其后随着循环系统影响大脑中的神经系统相关基因的表达以及发生可变剪切,从而导致相应的行为学异常。本研究也表明,肠道基因组作为人体的“第二基因组”,在自闭症的致病机制研究以及基因—环境互作的研究中可以为我们提供一个新的方向。
赛福点评
我们也需要注意到该研究以小鼠行为学为对象,而小鼠行为学较为复杂,易受外界环境影响;同时该研究样本量较少,因为肠道菌群的个体差异较大,选取的自闭症患者也并不能完全具有代表性,需要后续大量样本的研究。
对宏基因组学以及肠道菌群研究感兴趣的读者,可参考赛福基因大讲堂第47期《人体肠道微生物与相关疾病的研究进展》。
参考文献
[1]American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. 5th ed. Arlington: American Psychiatric Publishing, 2013.
[2]Lyall K, Croen L, Daniels J, et al. The changing epidemiology of autism spectrum disorders. Annu Rev Public Health, 2017, 38: 81–102.
[3]Herbert M R, Russo J P, Yang S, et al. Autism and environmental genomics. Neurotoxicology, 2006, 27: 671–684.
[4]Adams J B, Johansen L J, Powell L D, et al. Gastrointestinal flora and gastrointestinal status in children with autism--comparisons to typical children and correlation with autism severity. BMC Gastroenterol, 2011, 11: 22.
[5]Cryan J F, Dinan T G. Mind-altering microorganisms: The impact of the gut microbiota on brain and behaviour. Nat Rev Neurosci, 2012, 13: 701–712.
[6] Sharon G, Cruz N J, Kang D W, et al. Human Gut Microbiota from Autism Spectrum Disorder Promote Behavioral Symptoms in Mice[J]. Cell, 2019, 177(6): 1600-1618. e17.


