AJHG | AP1G1新发杂合和纯合错义变异导致神经发育障碍

网格蛋白有被囊泡介导活细胞细胞器的蛋白质运输,衔接蛋白(Adaptor protein,AP)是参与网格蛋白有被囊泡组装的一种蛋白质,主要起衔接作用。AP复合物由不同的亚单位组成,可分为5个细胞溶质亚家族,AP1G1编码AP-1复合物的γ-1亚单位蛋白。已有研究表明AP复合物不同亚单位的致病等位基因与智力障碍(IDs)等人类遗传病相关联。
2021年7月,美国马里兰大学Saima Riazuddin课题组在AJHG发表研究论文《De novo and bi-allelic variants in AP1G1 cause neurodevelopmental disorder with developmental delay, intellectual disability, and epilepsy》,通过研究AP1G1基因的蛋白构象、蛋白表达、亚细胞定位及蛋白功能,证实了该基因的突变会以功能缺失及显性负效应等方式对编码蛋白产生有害影响, 并利用斑马鱼ap1g1敲除模型证明其对个体生存的重要性,斑马鱼过表达实验结果则验证了部分新发错义突变存在显性负效应,进一步为AP1γ1在人类发育和认知功能方面的关键作用提供证据。
如图1,作者从11个家系中发现了2个纯合错义突变(c.737C>A[p.Pro246His],c.1105A>G [p.Met369Val])和8个新发杂合突变(c.44G>A [p.Arg15Gln],c.103C>T [p.Arg35Trp],c.104G>A [p.Arg35Gln],c.747G>T [p.Gln249His],c.2459C>G [p.Pro820Arg],c.229delC[p.Gln77Lys*11],c.399_400del [p.Glu133Aspfs*37,c.928-2A>C [p.?]),所有患者均患有神经发育障碍包括全面发育迟缓、不同程度的智力障碍、言语迟缓和行为问题,其中一些患者还患有肌张力减退、癫痫和肢体畸形。AP1G1编码的蛋白AP1γ1有四个跨膜结构域,在羧基末端有一个可与有被囊泡中的网格蛋白和其他受体结合的α衔接蛋白C2结构域,蛋白软件预测上述变异对编码的蛋白功能产生有害影响;而通过对AP1γ1的蛋白质三维建模分析显示突变会改变蛋白质的二级结构和蛋白折叠。
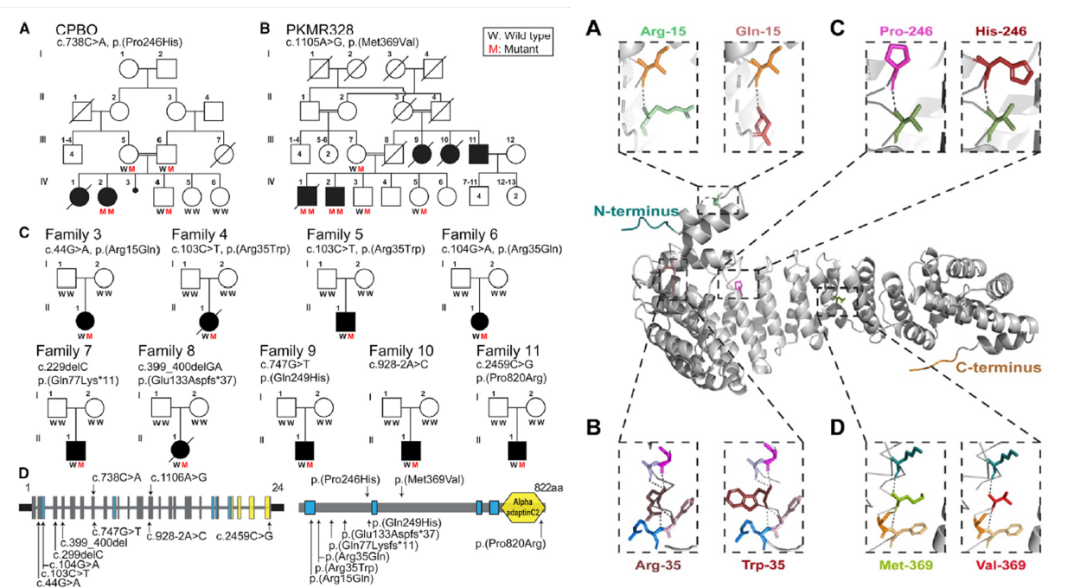
图1 患者家系图与基因蛋白序列结构以及蛋白3D建模图
为评估突变对AP1γ1蛋白水平的影响,研究者将8种突变分别转染到HEK293T细胞中进行蛋白表达分析。如图2A,与对照相比,错义突变中p.Arg15Glu、p.Arg35Trp、p.Pro246His和p.Pro820Arg导致AP1γ1的水平显著降低,p.Arg35Gln、p.Met369Val对应蛋白质水平显著升高;移码突变p.Gln77Lysfs*11、p.Glu133Aspfs*37两组则未观察到蛋白条带。通过加入蛋白酶体抑制剂MG132,移码突变细胞中均出现了截短的AP1γ1蛋白,这说明移码突变会导致蛋白的稳定性下降(图2B)。
接下来作者分析了突变的AP1γ1蛋白在COS7细胞中定位的变化(图2C)。正常细胞中,AP1γ1主要定位在核周区,p.Arg15Glu、p.Arg35Trp和p.Arg35Gln组会导致蛋白质聚集体形成,p.Pro820Arg则在整个细胞质中出现定位扩散,而移码突变组的蛋白荧光信号低,这也印证了移码突变会降低蛋白稳定性的结论。
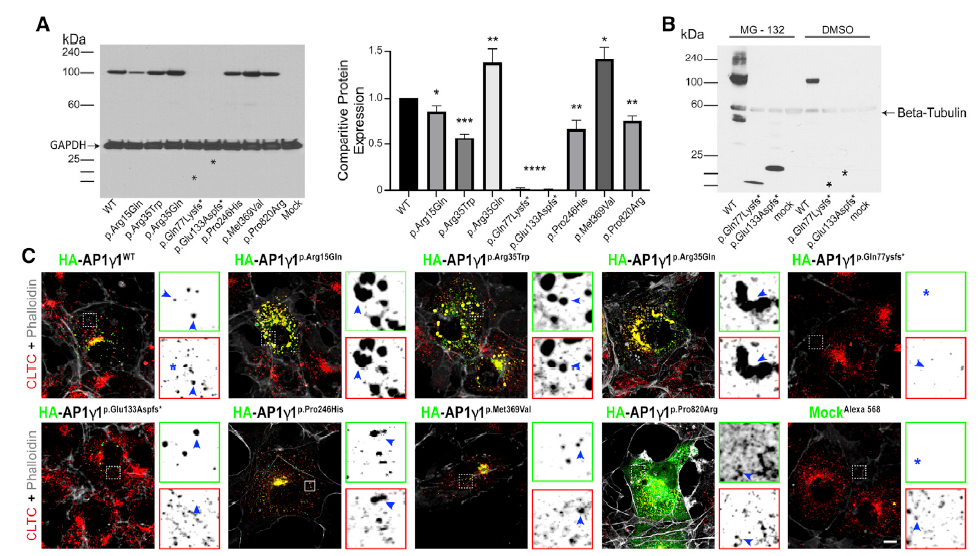
图2 AP1G1蛋白表达与亚细胞定位结果
本研究中除携带p.Glu133Aspfs*37突变患者的细胞系外,其余患者来源细胞系均无法正常培养传代,故作者通过体外过表达实验对野生型与突变蛋白质之间的相互作用进行分析。将野生型与不同突变的AP1G1共转染HEK293T细胞后,野生型AP1γ1蛋白相对稳态水平未受到影响,但含有p.Arg15Gln、p.Arg35Trp和p.Arg35Gln的突变AP1γ1蛋白会与野生型AP1γ1蛋白形成异常聚集,以上结果表明杂合的新发突变可能存在显性负效应(图3)。
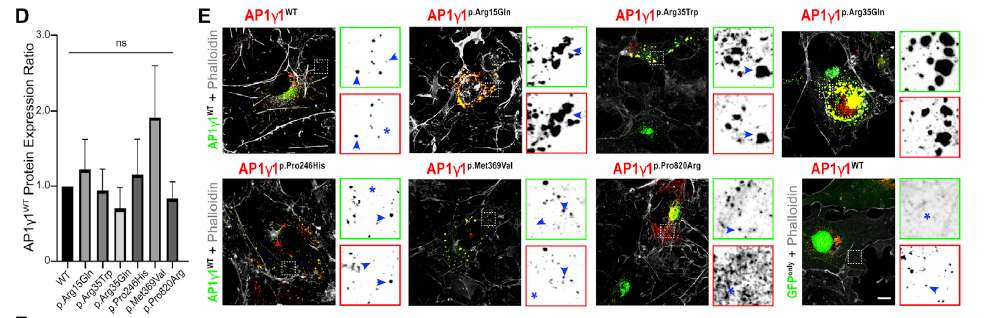
图3 体外过表达与免疫荧光结果
通过对携带p.Glu133Aspfs*37突变患者的成纤维细胞进行分析,作者发现细胞中AP1γ1蛋白水平低,而AP1G1 mRNA表达量正常,证明突变影响蛋白稳定,不导致无义介导的mRNA降解 (nonsense-mediated mRNA decay,NMD)。另外,患者细胞系中AP1β1、AP1μ1蛋白水平也显著下降,这表明AP-1复合物中不同亚单位存在相互稳定的作用(图4)。
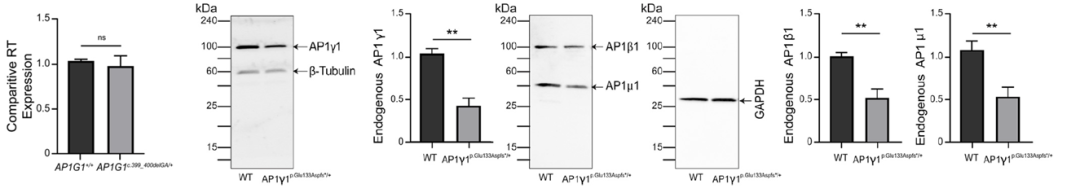
图4 患者成纤维细胞蛋白免疫印迹结果
免疫共沉淀实验显示双等位基因突变(c.737C>A[p.Pro246His],c.1105A>G [p.Met369Val])未影响AP-1复合物的形成。以前的研究表明AP1γ1通过内体参与转铁蛋白循环,因此作者通过COS7细胞中的脉冲追踪分析研究转铁蛋白内体循环途径,以评估p.Pro246His和p.Met369Val对整个AP-1复合功能的影响。与对照相比,p.Pro246His影响囊泡的募集过程,而p.Met369Val干扰循环内体和质膜之间的转运,两种突变都损害AP-1复合体的功能(图5)。
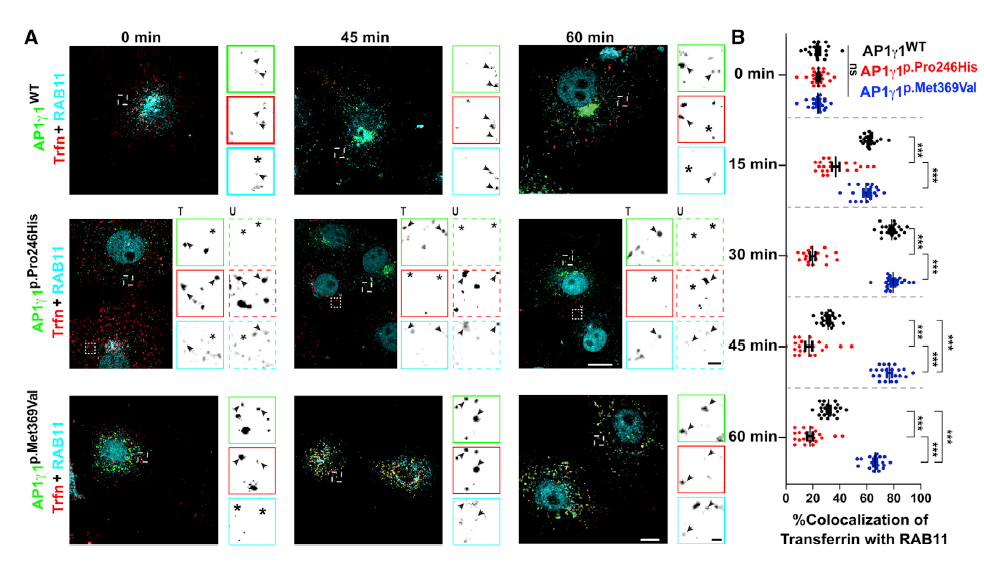
图5 不同突变对转铁蛋白内体循环的影响
作者通过研究斑马鱼模型来进一步了解突变在患者体内的致病机制。将已有的ap1g1+/-斑马鱼杂交,对产生的后代进行存活率测试,后代中ap1g1-/-个体水肿明显,从4 dpf开始大量死亡,只有16%的个体可以存活至9 dpf,这表明ap1g1在斑马鱼生存中起重要作用。通过注射人源野生型或突变的AP1G1 mRNA对ap1g1-/-斑马鱼进行挽救,野生型mRNA可显著提高ap1g1-/-存活率;p.Pro246His或p.Met369Val组可使幼鱼大量死亡的起始时间延后,但9 dpf存活率无变化,表明两种突变有害但基因功能未完全丧失;而注射带有p.Arg15Gln、p.Arg35Trp和p.Arg35Gln突变的mRNA则加速了幼鱼的死亡,印证了此三类突变的显性负效应(图6)。
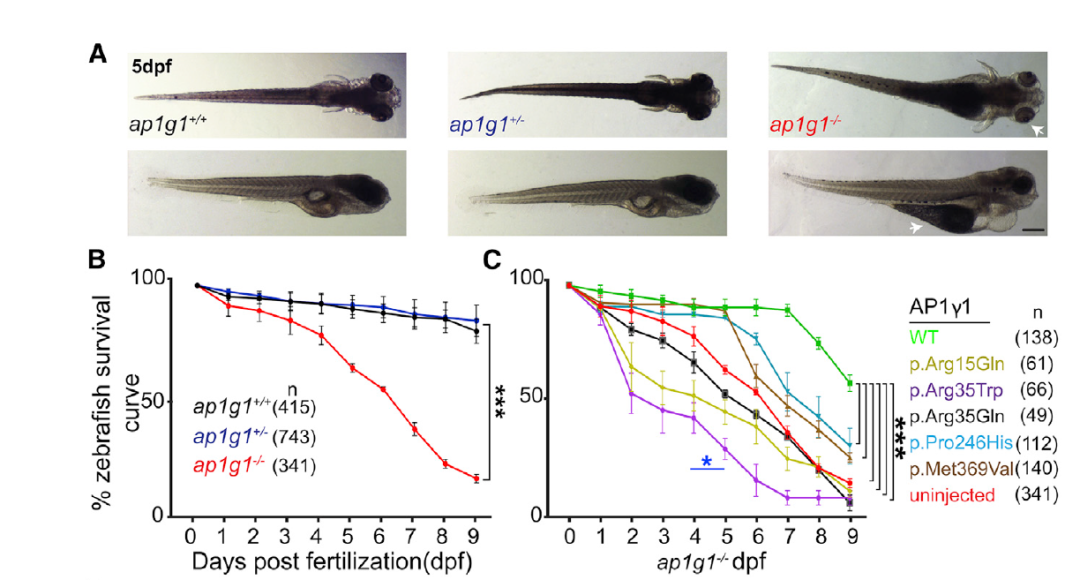
图6 斑马鱼模型结果
赛福基因现已开展“功能验证”服务,欢迎添加客服微信了解详情。
![]() 微信扫描/长按识别二维码:
微信扫描/长按识别二维码:



