赛福基因公开课《高通量筛选在渐冻症药物研发中的应用》
Part-1
嘉宾介绍
吴晨博士,本科毕业于南京大学生命科学院,博士毕业于北京大学生命科学院。个人兴趣为如何降低神经退行疾病中错误折叠的蛋白聚合物、神经细胞中的信号传递、以及基因敲除/修复技术在神经退行疾病上的应用。目前在哈佛大学干细胞与再生生物学院做博士后研究,主要方向为利用诱导多能性干细胞(iPSC)平台体外构建渐冻症(ALS)疾病模型,寻找新型靶向药物以及渐冻症中运动神经损伤的机理。
Part-2
公开课环节

大家好,我是来自美国哈佛大学干细胞与再生生物学的吴晨博士,目前从事渐冻症以及其它神经退行疾病的药物研发与机理研究。感谢赛福基因的邀请和大家的参与。今天和大家简单分享一下在药物研发中常用的高通量筛选的应用。同时我会简略地介绍一下基因编辑技术在神经疾病治疗中的作用和前景。

这次的内容大概分为三个方面:首先是渐冻症(ALS)的背景知识,然后我会介绍高通量筛选的流程方法,在ALS药物开发中的应用包括几个实例。最后我会简要介绍一下基因编辑技术和高通量筛选的结合应用以及基因编辑在疾病治疗中的前景。

上图是比尔盖茨在进行冰桶挑战。冰桶挑战开始让大家更多地关注一个可怕的疾病,那就是渐冻症,或者叫渐冻人症。冰桶挑战为渐冻症研究和护理筹集了大量资金。
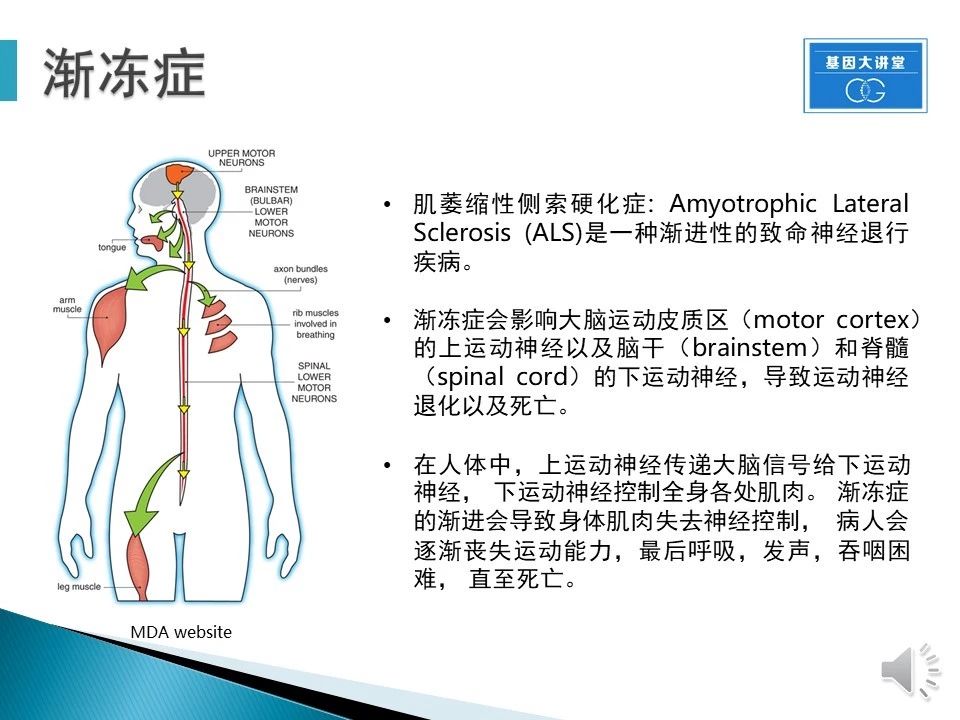
渐冻症的学名是肌萎缩性侧索硬化症: Amyotrophic Lateral Sclerosis (ALS),这是一种渐进性的致命神经退行疾病。病症主要影响运动皮质区的上运动神经以及脑干和脊髓的下运动神经,导致运动神经退化。在正常人体内,大部分肌肉尤其是骨骼肌都被运动神经控制,当神经信号传递时,骨骼肌可以正常接收运动神经指令,进行收缩或扩张。在ALS患者体内,运动神经受损,逐渐丧失与骨骼肌的联系,导致肌肉失去指令控制,病人会逐渐丧失运动功能,最后无法呼吸,吞咽,直至死亡。值得一提的是,运动神经损伤并不影响心肌、肠胃消化道蠕动以及大脑思维。

目前全世界大约有45万ALS患者,占总人口数的1~2%。ALS是一个较晚发病的疾病,通常在40-70岁之间发病,患者一般在2-5年内死亡,只有10%患者可以生存10年以上,5%可以存活20年以上。ALS的诊断相对比较复杂,需要一系列的综合诊断,通过排除其它肌萎缩疾病来确认。
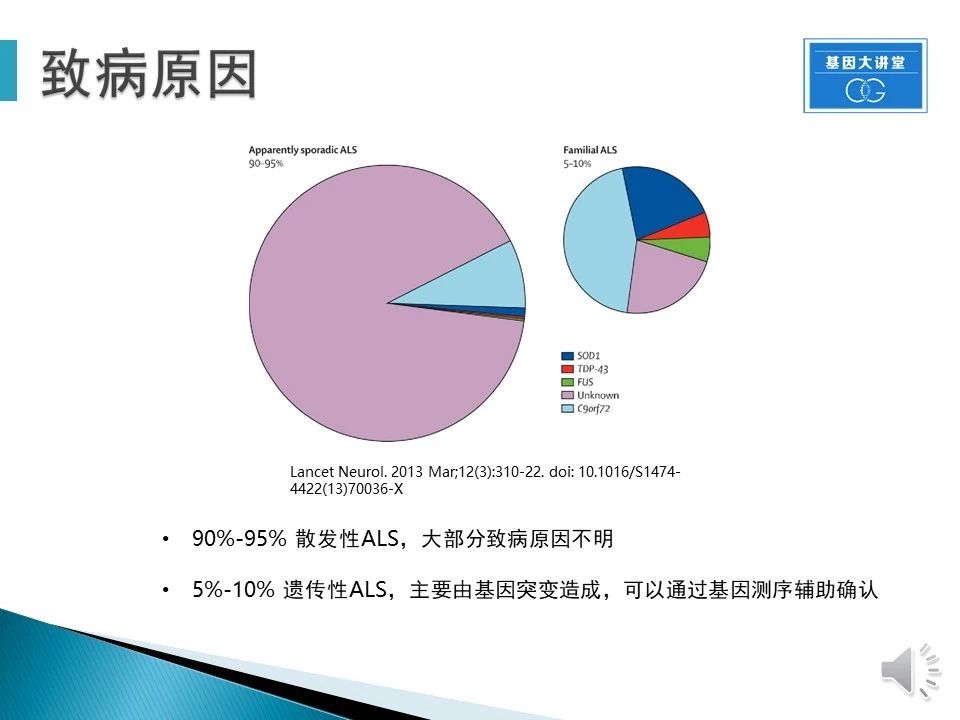
ALS一般可以分为两个大类。5-10%为家族性或者叫遗传性ALS,主要由基因突变引起,这部分病人可以通过基因测序,分析家族历史来进行早期确认。90-95%为散发性,致病因素很复杂,目前并没有非常确定的结论。
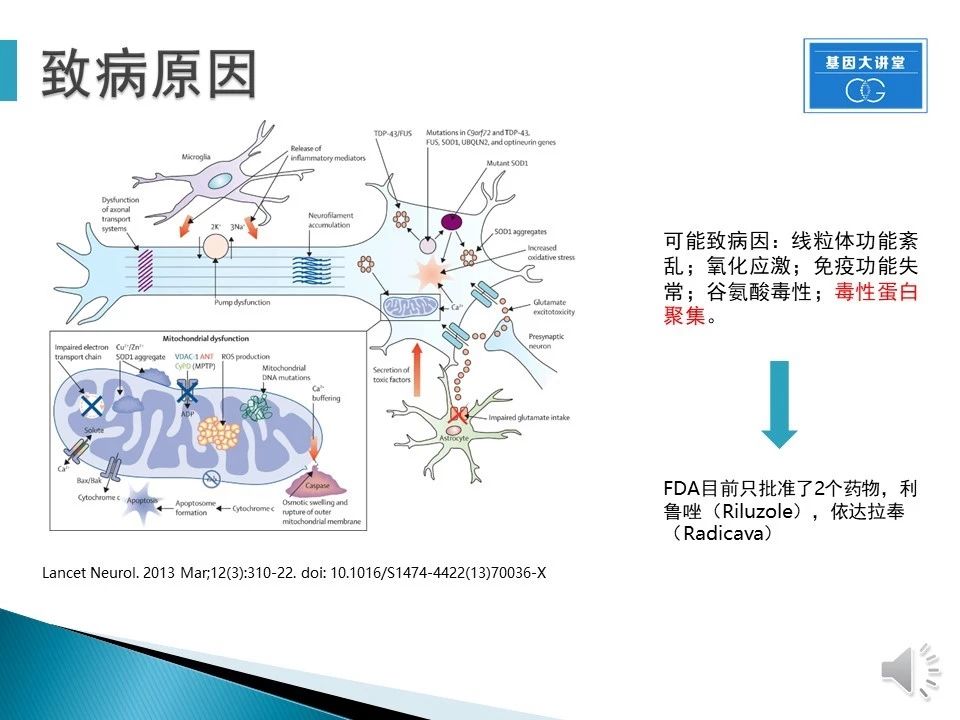
在目前的研究和认知中,ALS的致病机理分为两大类,即细胞自主性和非细胞自主性。细胞自主性指的是神经细胞自身的问题,包括线粒体功能紊乱、氧化应激、免疫功能失常、谷氨酸毒性、毒性蛋白聚集。非细胞自主性指的是和神经细胞共存的其它细胞异常导致的神经细胞退行现象,如小神经胶质细胞会影响运动神经细胞。因为致病因素的多样性和复杂性,目前FDA只批准了2个药物,但是对于患者的作用非常有限。值得一提的是,毒性蛋白聚集,在大量的ALS患者中都有发现。不仅如此,几乎所有的神经疾病都涉及到蛋白聚合物的毒性和扩散,也是目前大量神经疾病研究中的重点。
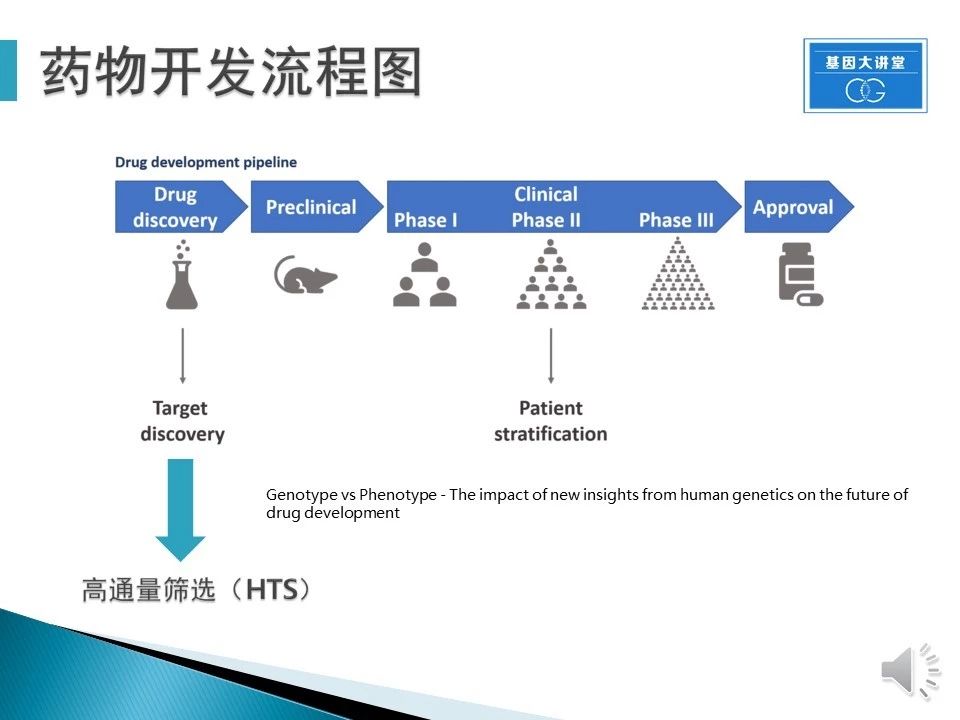
目前大部分的神经退行疾病都没有有效的药物,所以整个领域对于药物研发都很重视。药物研发的流程主要分为:药物开发、临床前试验、临床测试。而第一个药物开发和靶点开发就需要用到高通量筛选技术。

高通量筛选技术是以分子水平和细胞水平的实验方法为基础,以微板形式作为实验工具载体,以自动化操作系统执行试验过程,在同一时间检测数以千万的样品,再以计算机分析处理实验数据。

HTS应用广泛,因为其优点明显:省时、高效、准确、低耗。
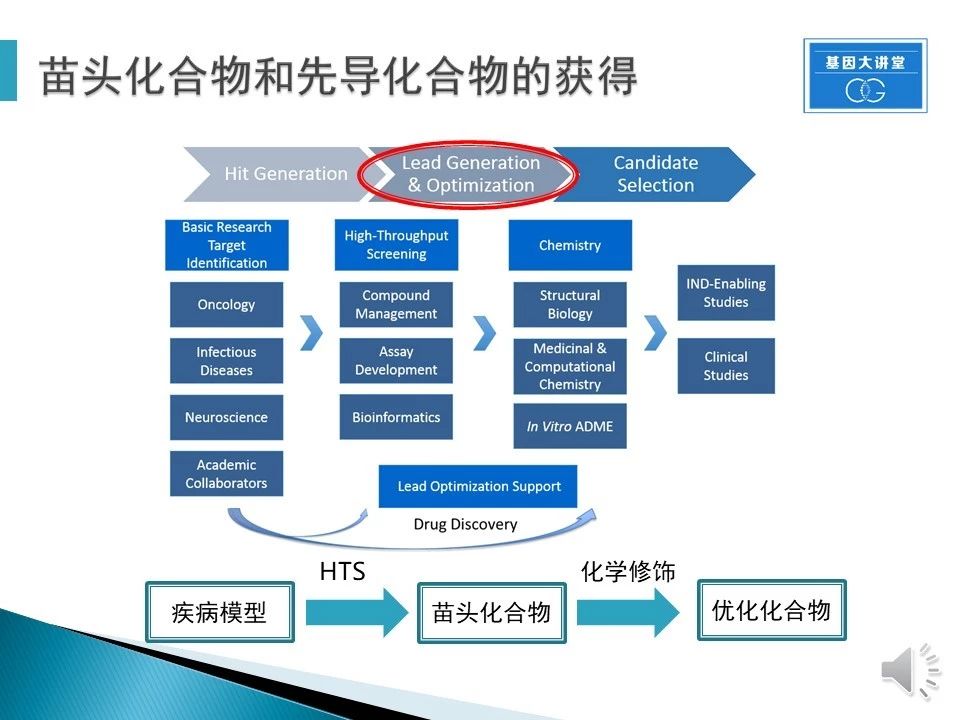
在药物研发中,获得先导化合物(lead compound)是极为重要的第一步。首先我们需要针对我们的需求设计疾病模型(体外或者体内),然后通过高通量筛选获得初步有效的化合物,随后通过确认效果找到一个或几个有效的靶点已知的化合物,即苗头化合物,再在此基础上设计毒性更低,效果更好的一族化合物,即为先导化合物。这样就算药物研发第一大步骤的完成。
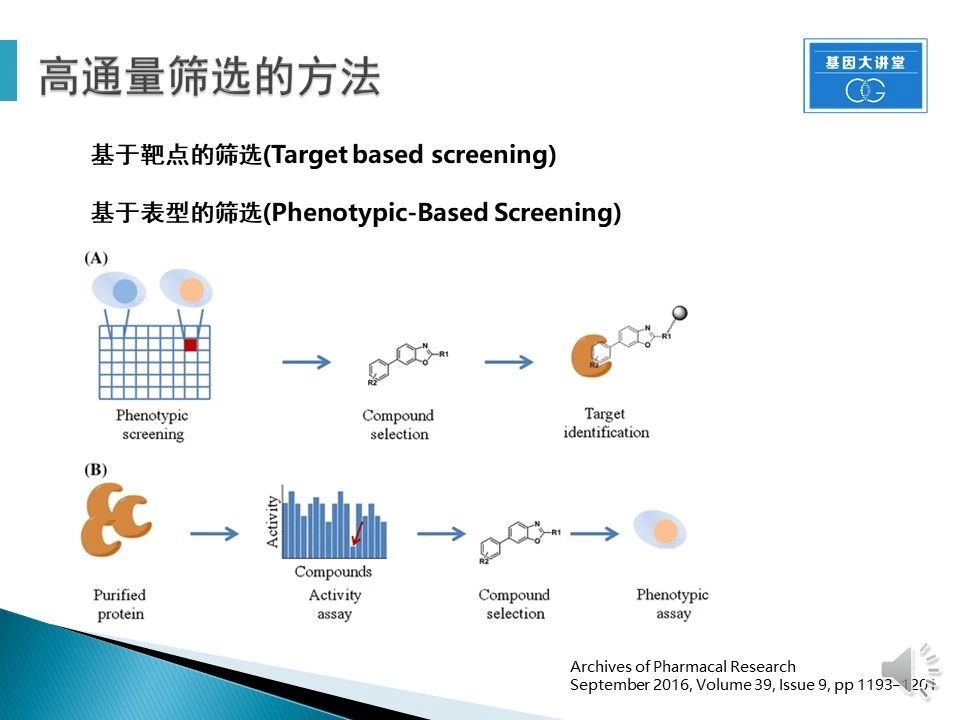
HTS根据目标不同,可以分为不同的筛选策略,常用的有两种:基于靶点的筛选和基于表型的筛选。在已知靶点的情况下,多使用前者,如肿瘤靶向药物筛选;在未知靶点情况下,以产生变化的表型为读出,常使用后者。
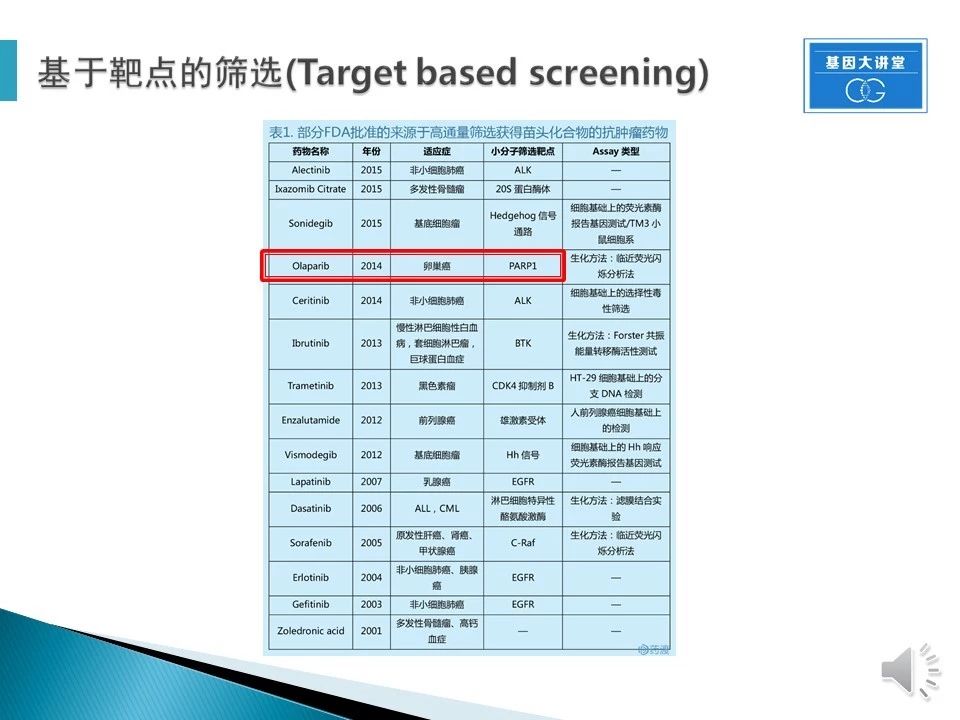
表格是部分FDA批准的来源于高通量筛选获得苗头化合物的肿瘤药物,都是基于已知靶点进行的HTS。下面我将以卵巢癌药物奥拉帕尼(Olaparib)为例说明从HTS获得苗头化合物和先导化合物的重要。
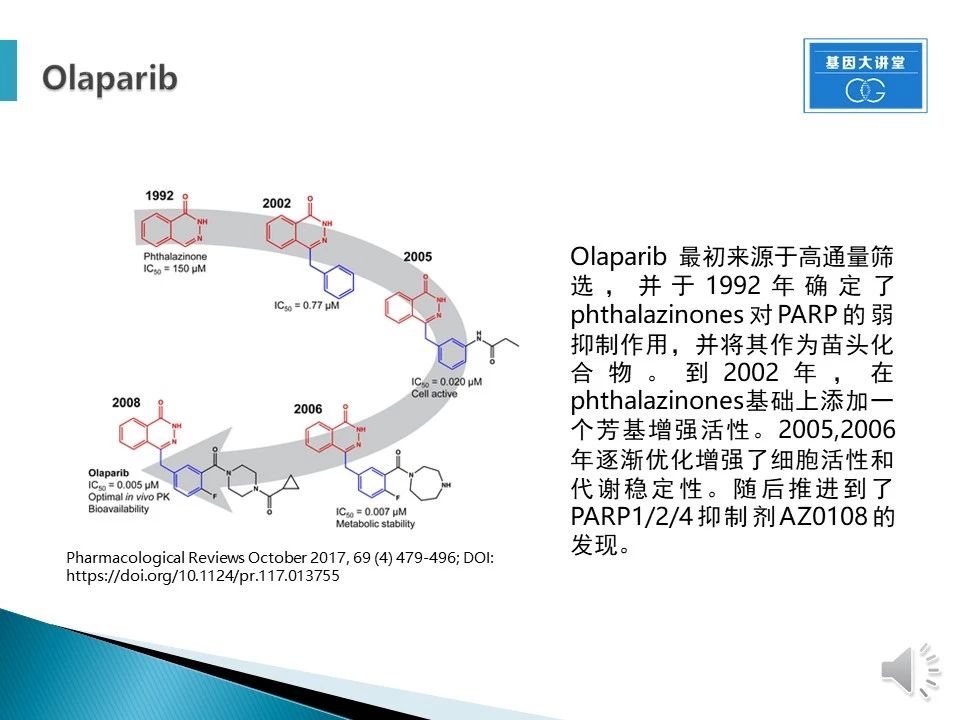
PARP很早就被揭示过与BRCA1/2失活后DNA损伤修复有关,针对卵巢癌BRCA1/2突变,研究人员开始关注PARP抑制剂。奥拉帕尼最初来源于高通量筛选产物phthalazinones,其对于PARP有一定的抑制作用。以其为苗头化合物,进行优化。从05-06年优化获得细胞活性与稳定的代谢活性,到08年优化获得的对BRCA1缺失细胞的选择性毒性。整个过程历经多个优化过程,历时十多年。

以上是基于靶点的筛选,我们已知了PARP靶点对于BRCA1的重要性,再进行的筛选和优化。但是对于很多疾病,有很多靶点是未知的,这就涉及了基于表型的筛选。根据表型的差异(细胞生存与凋亡、细胞功能性获得等)获得一系列不同活性候选化合物,这些化合物可能针对不同靶点有不同的作用机理。这种方法也是目前最常用的方法。
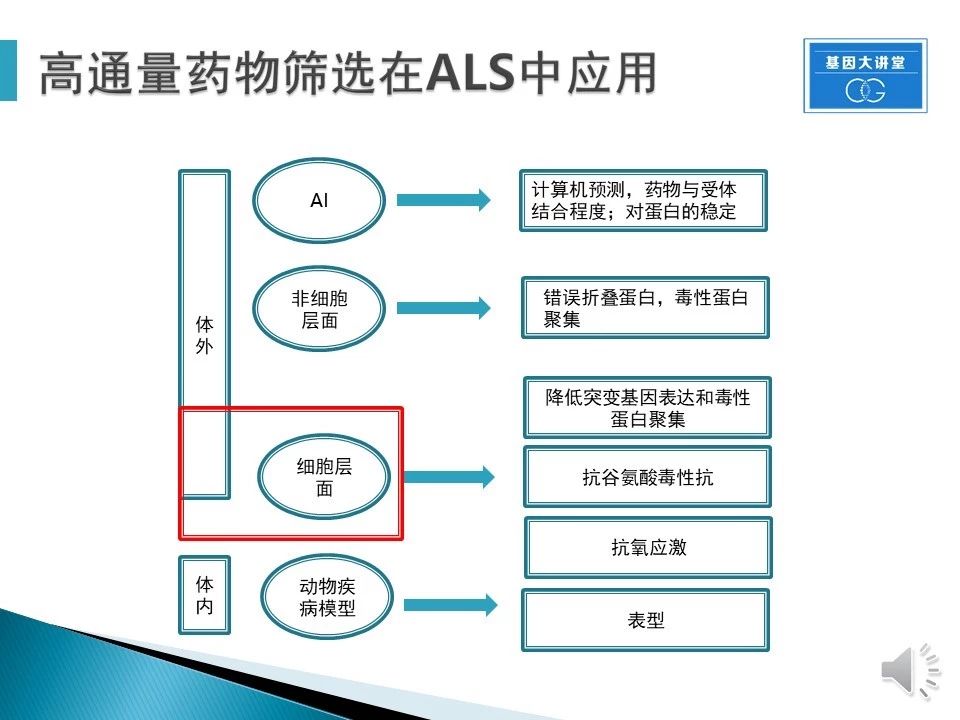
那么在ALS药物开发中,HTS有怎么样的应用?目前分为体外筛选与体内筛选两大方面。体外的筛选又主要有AI层面、非细胞层面与细胞层面;体内主要是动物模型筛选。这里我们主要介绍一下细胞层面的筛选,这是目前最主要的苗头化合物来源。

对于运动神经这类高度依赖功能性的细胞,在高通量的基础上,我们通常还需要另一个技术的结合,就是高内涵(high-content)。高内涵技术是一种用数码影像的方式获得筛选细胞多方面生物信息的一种方法。这种技术可以获得细胞水平上多个指标的分析并可以通过对影像图片进行不同种类的分析获得不同方向的研究结果,优势明显。
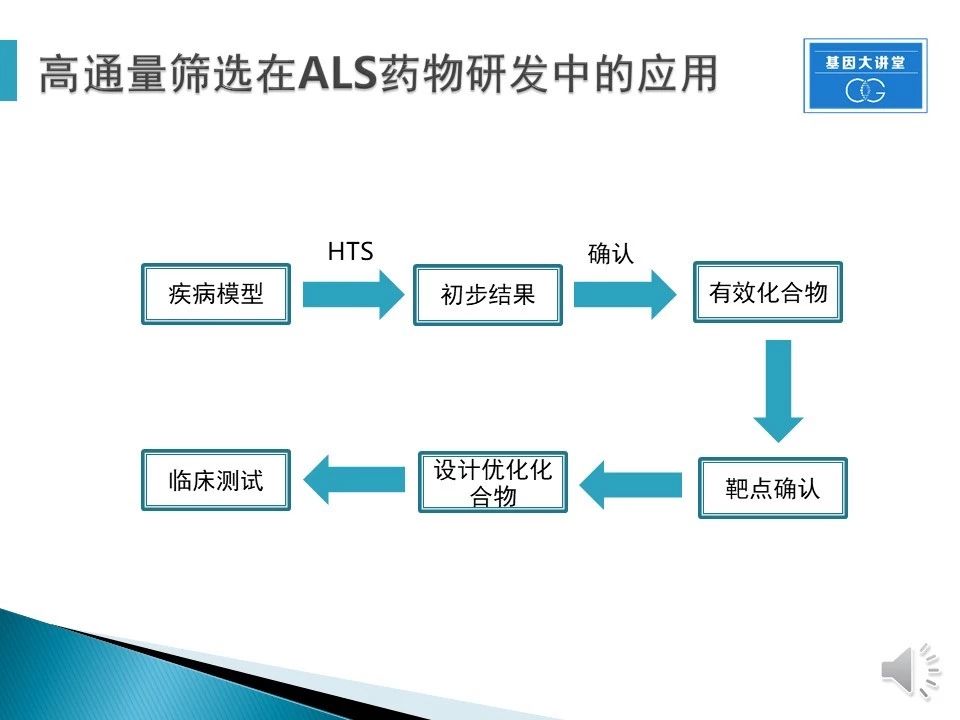
上图为在ALS药物研发流程中,高通量筛选需要历经的过程。
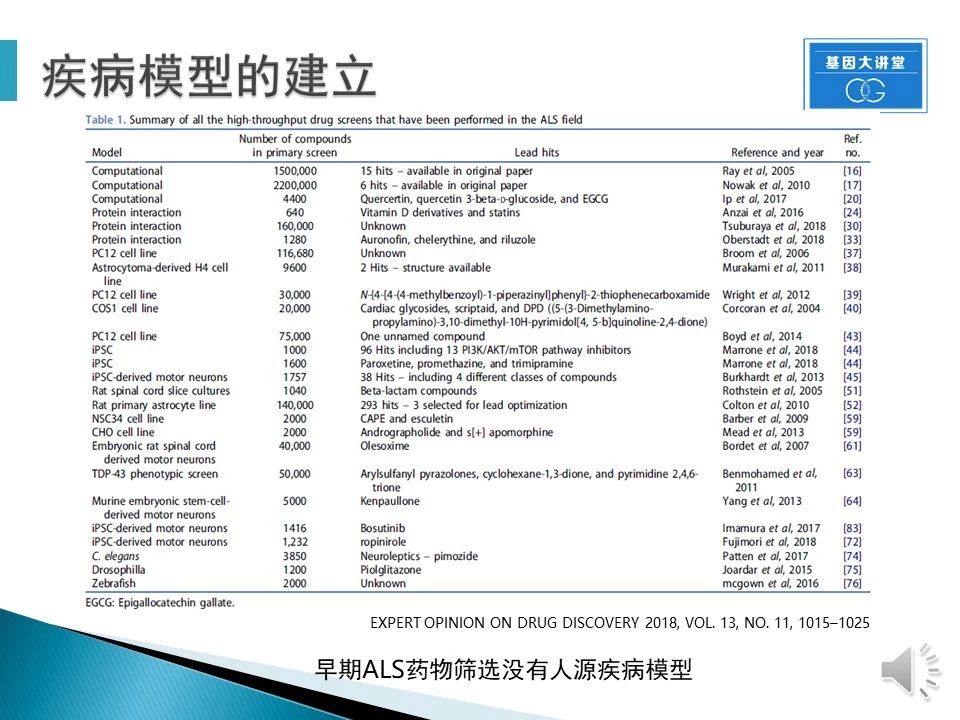
疾病模型的建立在ALS药物研发(包括其它疾病的药物研发)中非常重要。在ALS药物筛选的早期,几乎没有以人类疾病细胞建立的模型,所以大量的在其它模型上获得的有效药物无法通过临床试验。
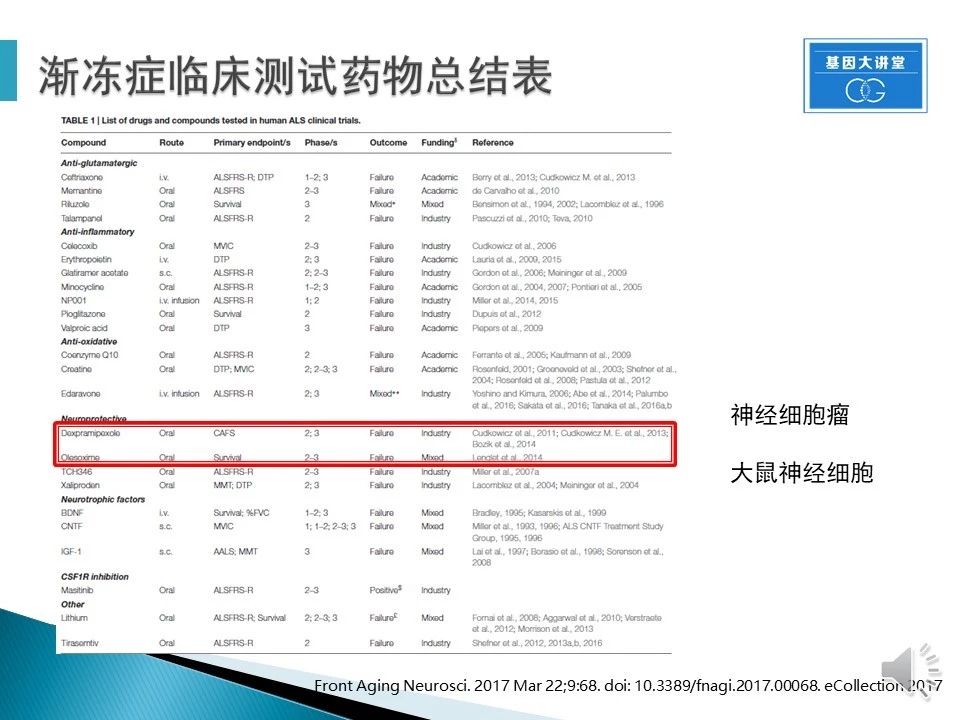
这是一个经历临床测试的ALS药物的表格,几乎所有的药物都失败。以最近的两个药物Dexpramipexole和Olesoxime为例,它们分别是从人神经细胞瘤和大鼠神经细胞中筛选获得,但是在临床上都显示对患者无效。由于伦理原因,早期几乎无法建立人源疾病模型。
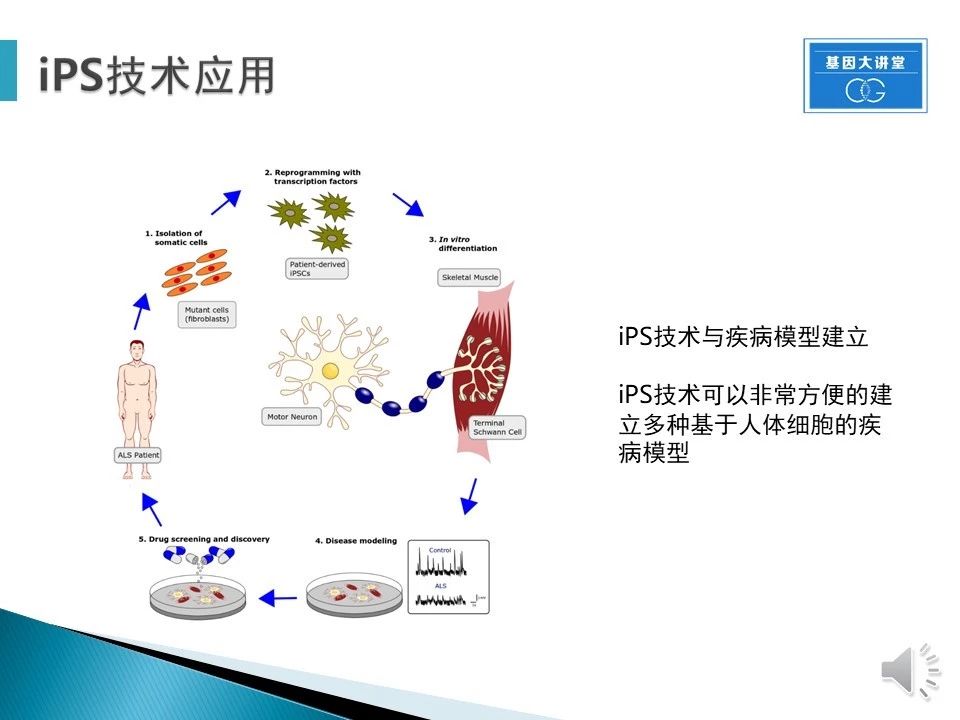
随着iPSC技术的广泛应用,很多疾病都可以通过iPSC技术建立体外模型,这对于药物开发意义重大。通过获得ALS患者的体细胞,建立干细胞系,体外分化至运动神经细胞,这样就获得了疾病的体外模型。
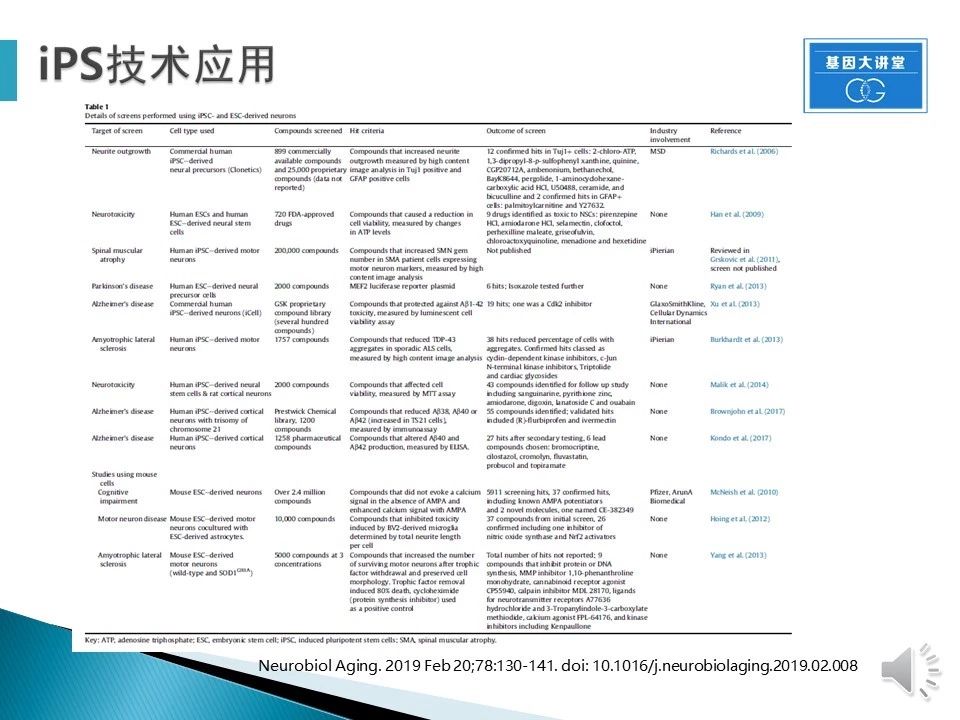
上表显示使用iPSC/ESC平台获得的体外模型进行的筛选,包括但不限于各类神经疾病。
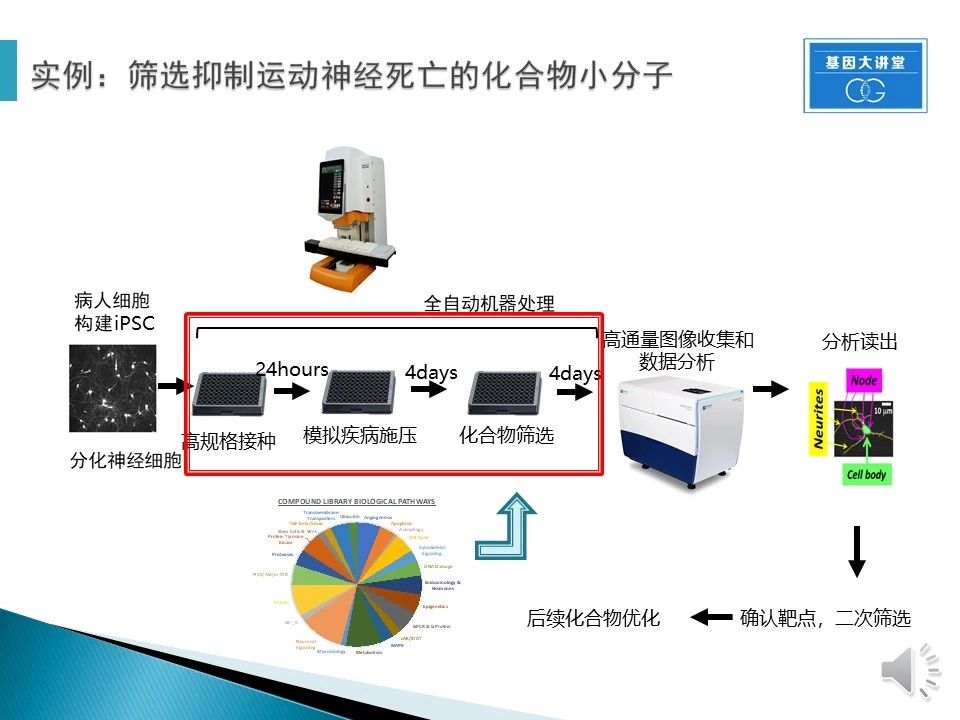
以我的部分工作为例:大家知道,几乎所有的患者在被诊断出ALS前,患者的运动神经就已经被损伤了,我就需要筛选使疾病运动神经恢复健康的药物。首先,我通过iPSC技术,获得了我想研究的某一类ALS的疾病模型(SOD1突变),在小孔中接入细胞,模拟疾病对运动神经进行损伤,损伤后筛选能够让神经恢复功能的药物。通过收集细胞的各方面数据,进行大量的数据分析,找到需要的药物,再进行确认和优化。整个筛选方法的设计和数据的获得对于最后结果非常重要。
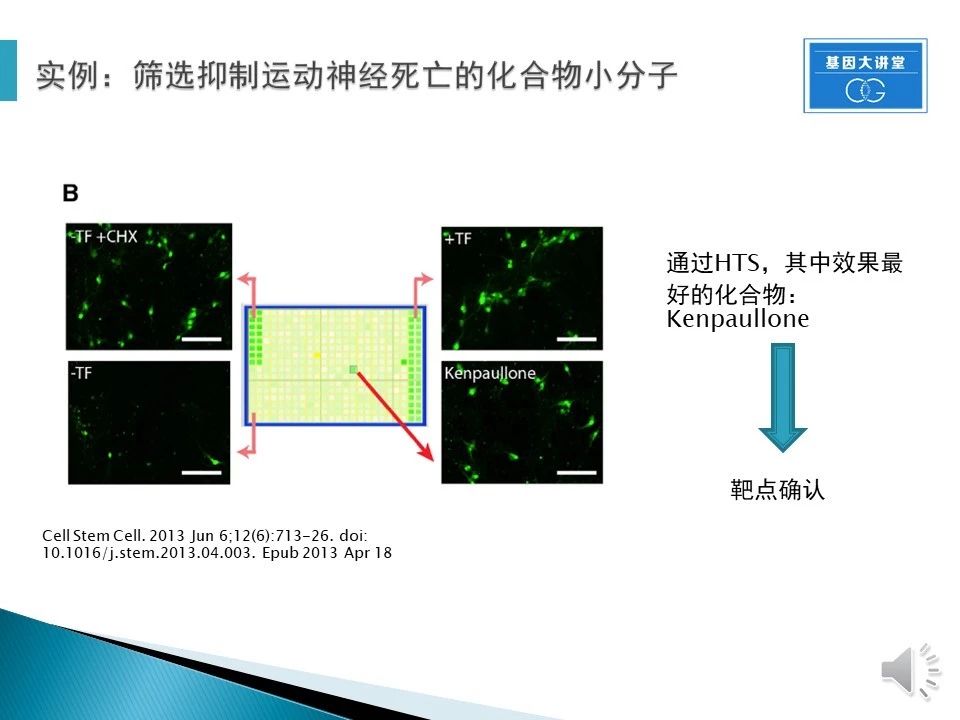
通过HTS,发现了一系列的有效化合物,其中Kenpaullone效果最好最稳定。但是Kenpaullone不是单一靶点化合物,需要我们确认是哪个靶点发挥作用。
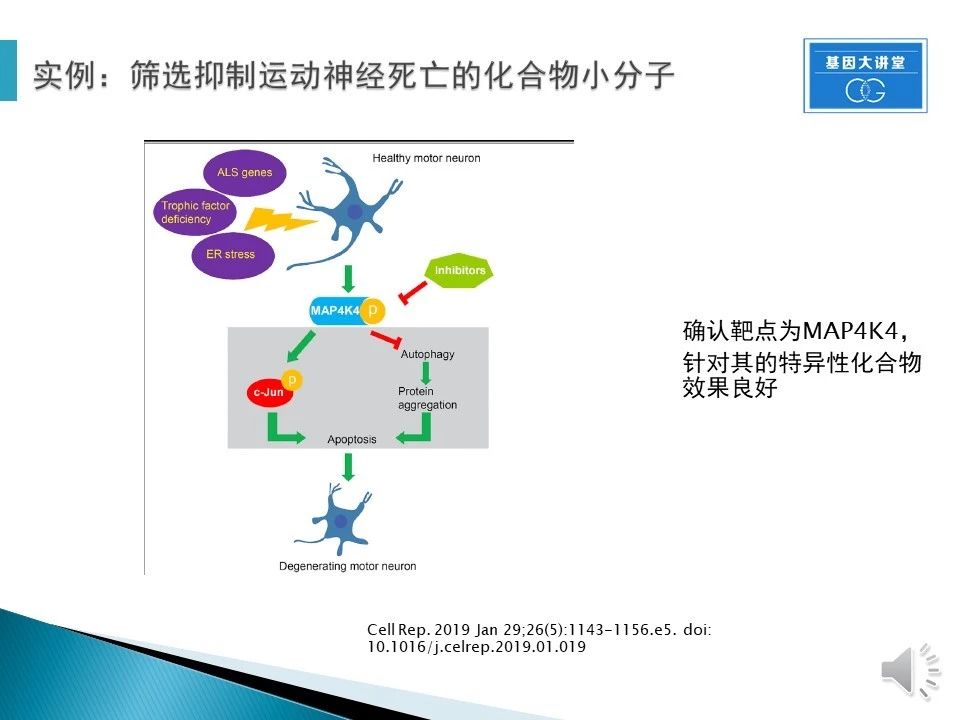
通过一系列的实验,我们确认了靶点为MAP4K4。针对这个靶点的特异性化合物有着非常好的保护效果。不仅能够抑制运动神经死亡,而且极大的保护其功能。同时也摸清了该靶点的作用机理,为临床实验打下基础。

上图为HTS中的几个关键节点。
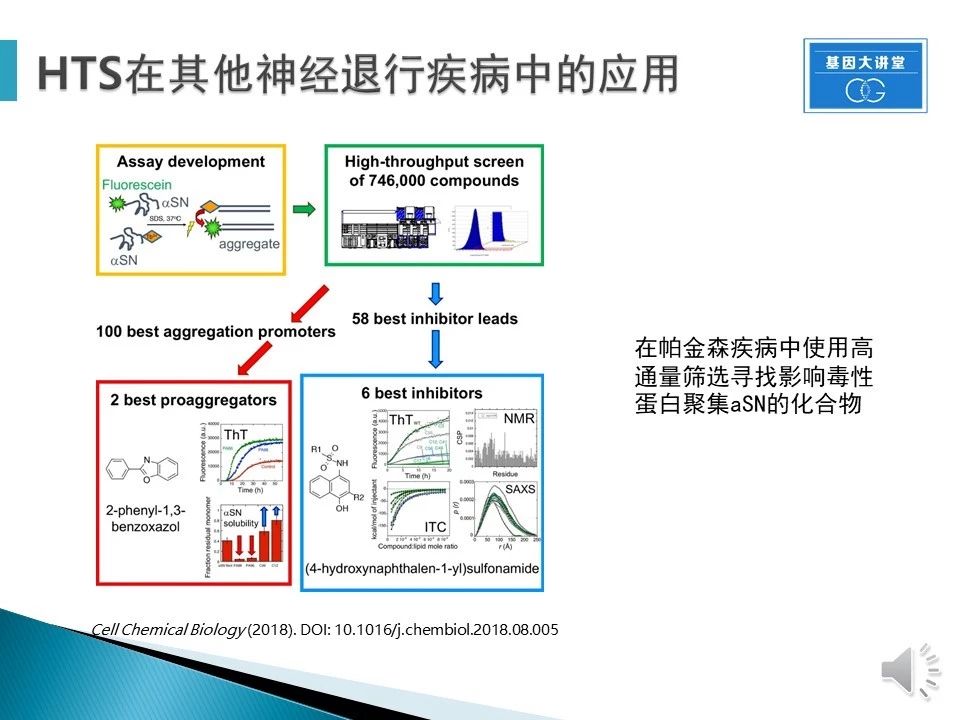
HTS在帕金森疾病中的应用。已知aSN蛋白聚合物在帕金森疾病中的毒性(已知靶点),通过筛选获得58个有初步抑制作用的化合物,经过确认找到6个效果最好的化合物。后续可以通过优化获得靶点特异性更好,效果更好的先导化合物。
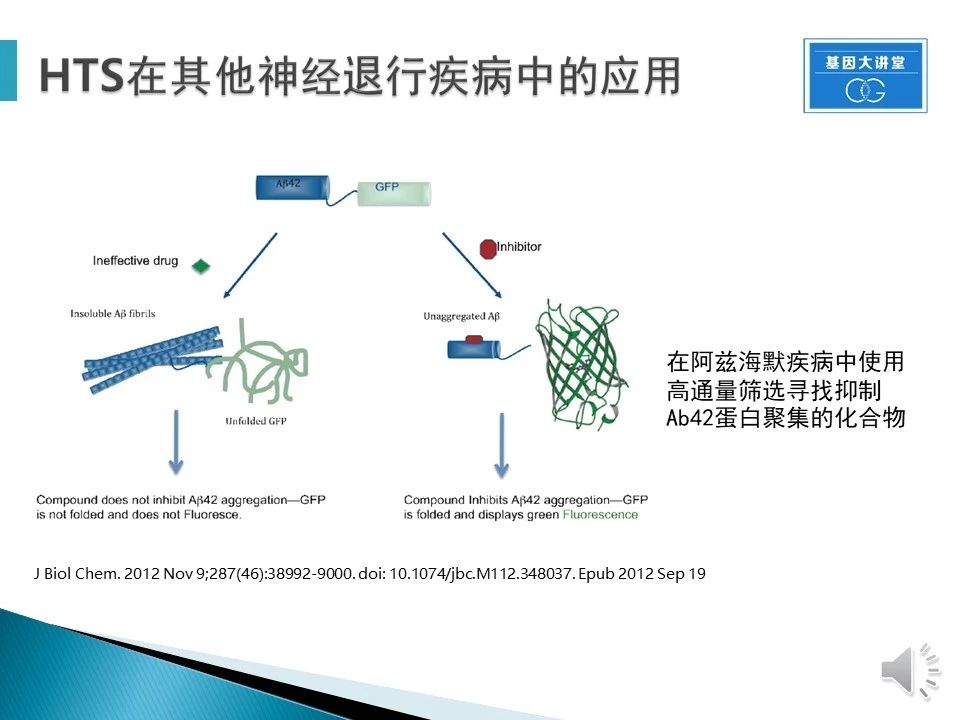
HTS在阿兹海默症中的应用。同样针对Ab42蛋白聚合物,设计筛选,当化合物能够抑制Ab聚集,就可以通过正确折叠的GFP蛋白表达绿色荧光,结合已知靶点和表型筛选,获得结果。
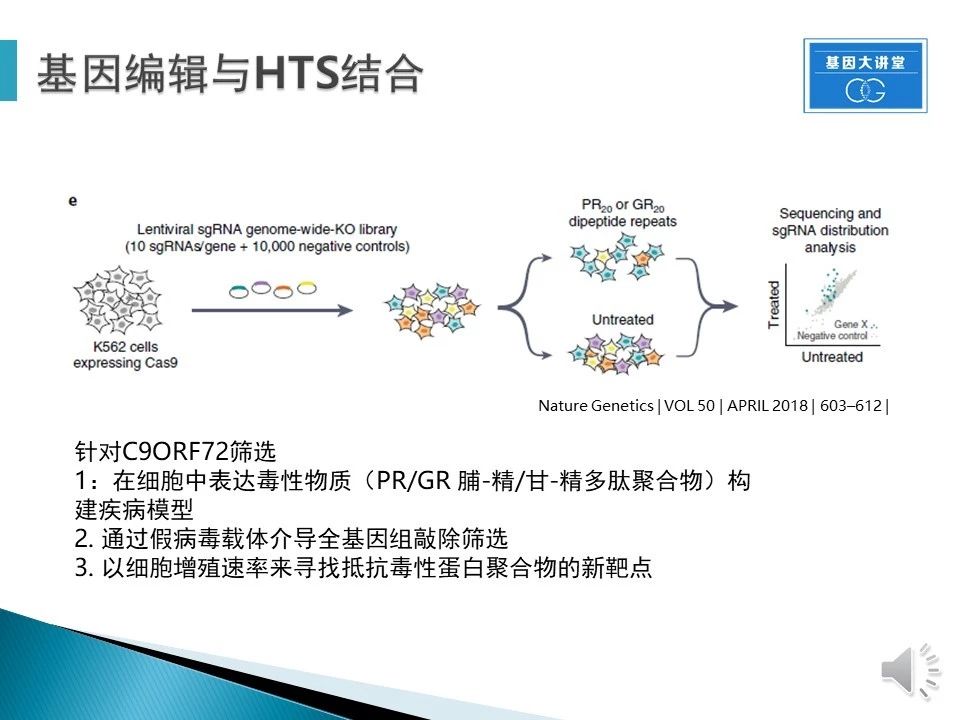
基因编辑技术是当前非常热门与有效的技术,当基因编辑技术与HTS结合,可以完成大规模的未知靶点筛选。以ALS中突变基因C9为例,临床中发现患者体内有大量精氨酸富集的蛋白聚合物,而这种聚合物有极大的细胞毒性。通过对模型细胞中基因组规模的敲除,科研人员可以得知哪些基因的缺失可以抑制蛋白聚合,从而为治疗提供新的靶点。
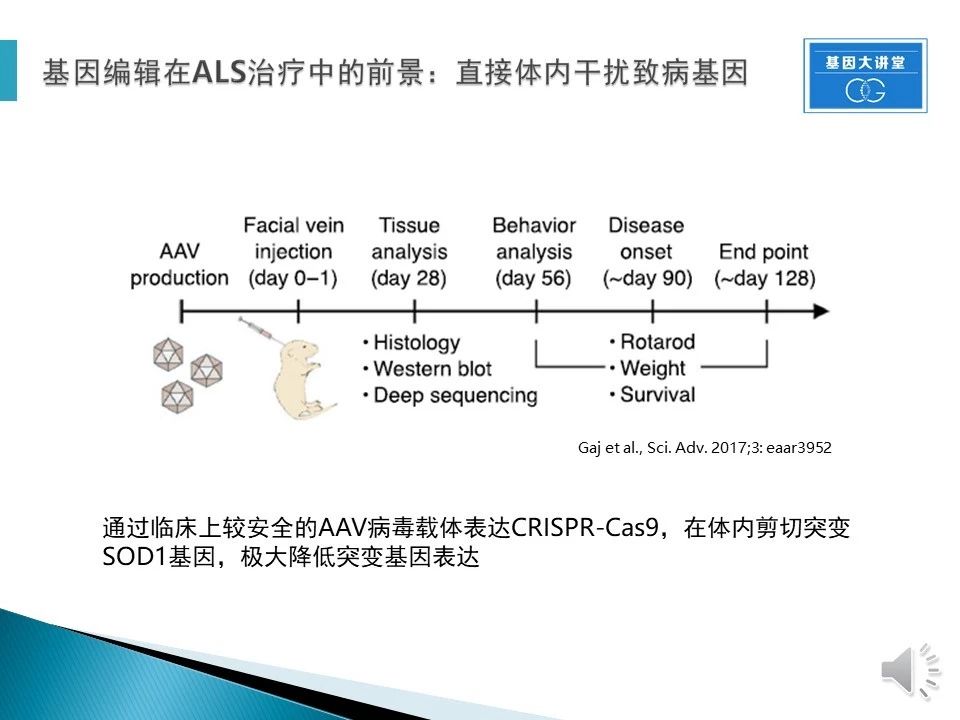
此外,基因编辑技术的广泛应用还包括当前热门的基因治疗。简单来说,就是通过CRISPR技术在体内对突变基因进行剪切,以达到治疗疾病的目的。

以上为总结。

致谢!
Part-3
问答环节
观众a:
吴老师您好,渐冻症很大程度上是基因突变引起的,这些基因突变是否导致了功能缺失?能否通过表达正常的基因来干预疾病的进程同时治愈疾病?
吴晨老师:
您好,渐冻症的治疗绝大多数是无法通过表达正常基因来达到的,因为大多数的基因突变,导致的不是功能性的缺失,而是一种细胞毒性。比如很常见的SOD1的突变,也就是超氧化物歧化酶的突变,这个突变会导致突变蛋白错误折叠,最后聚合,突变蛋白也会和正常蛋白聚合,所以无法通过正常蛋白表达来治疗疾病。
观众b:
老师您好,在高通量筛选中,如何减少假阳性结果的出现?如何增加筛选的可靠性?
吴晨老师:
筛选中的可靠性最主要是筛选体系和筛选策略的选择,尤其是在筛选策略上,要保证阳性对照和阴性对照之间的差距,同时通过梯度实验设计来减小误差。
观众c:
吴老师您好,请问高通量筛选策略的选择,是用表型筛选好还是靶点筛选好?
吴晨老师:
这两种筛选策略都很常用,一般对于靶点确定的,靶点筛选会更直接,但是相对会有局限性。比如针对Ab42的筛选,会出现很多有效的化合物或者抗体,但是目前所有抗体都没有有效的。所以现在很多都是两种方法结合,既针对靶点,也看表型。
观众d:
吴老师您好,感谢您的分享,可以简单介绍一下蛋白聚合物的毒性方面的研究吗?
吴晨老师:
蛋白聚合物的毒性目前是整个神经疾病领域的热门,因为在很多或者说绝大多数的神经疾病中都有发现各类蛋白聚合物。以我做的渐冻症为例,几乎所有的突变都会导致突变蛋白的错误折叠,这种错误折叠的蛋白会聚合在一起,变成类似朊病毒一样的聚合物。更可怕的是,不仅突变蛋白会聚合,突变蛋白也会和正常蛋白聚合,而这种蛋白聚合物会严重影响运动神经之间的正常交流,最后导致运动神经的死亡。目前很多研究机构都在针对这方面寻找能够加速降解蛋白聚合物的药物,有的甚至先在酵母中确定靶点,再在人细胞上验证,这样可以先获得靶点。
观众d:
所以针对点突变导致错误折叠这种类型的突变,从基因层面来说,移码突变导致的截短蛋白会不会症状更轻?
吴晨老师:
相对来说,整基因敲除或降低表达会减轻症状,移码突变不会或者说不一定会。目前的基因治疗针对的几乎都是整基因敲除或者抑制,但是最近有文献发表指出CRISPR会导致RNA被修改,所以目前基因疗法的安全性是个大问题。
观众e:
老师您好!在渐冻症药物开发中,获得苗头化合物后,需要优化的方向是什么?
吴晨老师:
一般优化都是加强靶点特异性,降低毒性等,针对神经疾病一般要强调血脑屏障的穿透,很多药物最早是没有穿透性的,也就无法作用到中枢神经系统。顺便再说一点,在渐冻症中,蛋白聚合物会出现在神经细胞周边的astrocyte里,但是对其没有毒性,只对运动神经有毒性。


