赛福基因公开课《DNA修复缺陷在肿瘤精准治疗中的价值及应用》
Part-1
嘉宾介绍
蔡木炎,哈佛医学院Dana-Farber Cancer Institute博士后,主要从事肿瘤DNA损伤与修复在肿瘤个体化治疗的应用及机制研究。
Part-2
公开课环节

大家好,我叫蔡木炎,原来是中山大学附属肿瘤医院病理医生,现在为Dana-Farber cancer Institute博士后,我主要研究方向为肿瘤DNA repair机制及其在肿瘤个体化治疗中的应用。感谢组织者的邀请,非常高兴能借助这个平台与大家交流。今天我将跟大家一起探讨DNA修复缺陷在肿瘤精准治疗中的价值及应用。

今天我将从以下三个方面进行汇报:首先我会从总体上介绍DNA修复的类型及通路,随后将讨论肿瘤DNA修复缺陷在化疗药物耐药、靶向治疗中的应用。
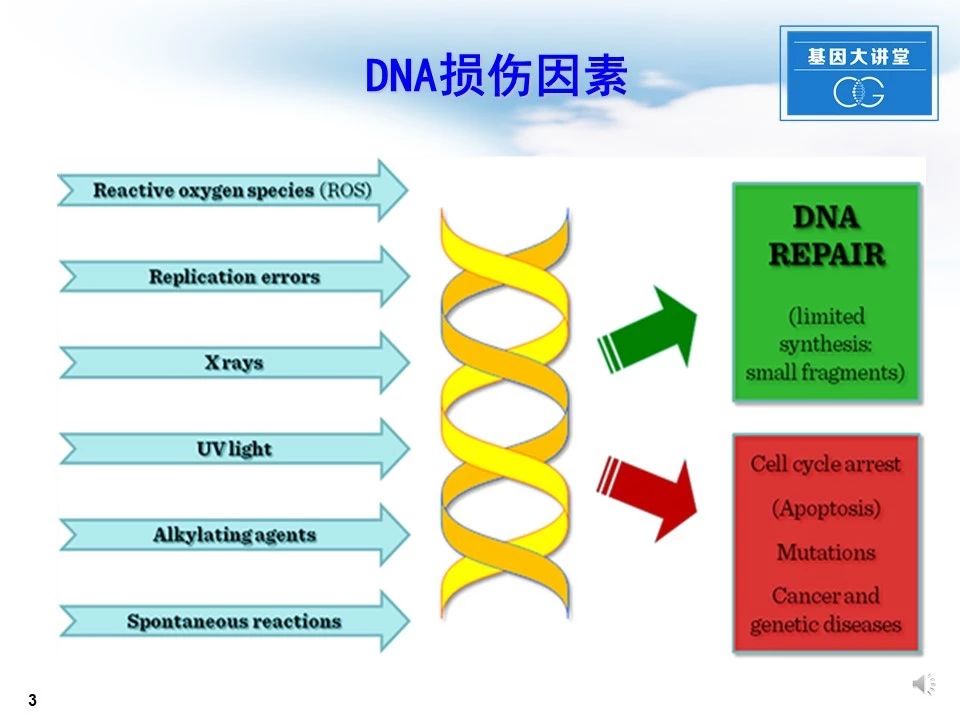
真核细胞在各种内源性(如氧自由基、复制错误)与外源性因素(如射线、紫外线、烷化剂等)作用下,将发生DNA损伤,机体通过激活一系列修复机制进行DNA修复(在损伤局限性、小片段时较为多见);同时,DNA损伤也可以导致细胞周期阻滞、基因突变,从而导致肿瘤发生遗传性疾病。
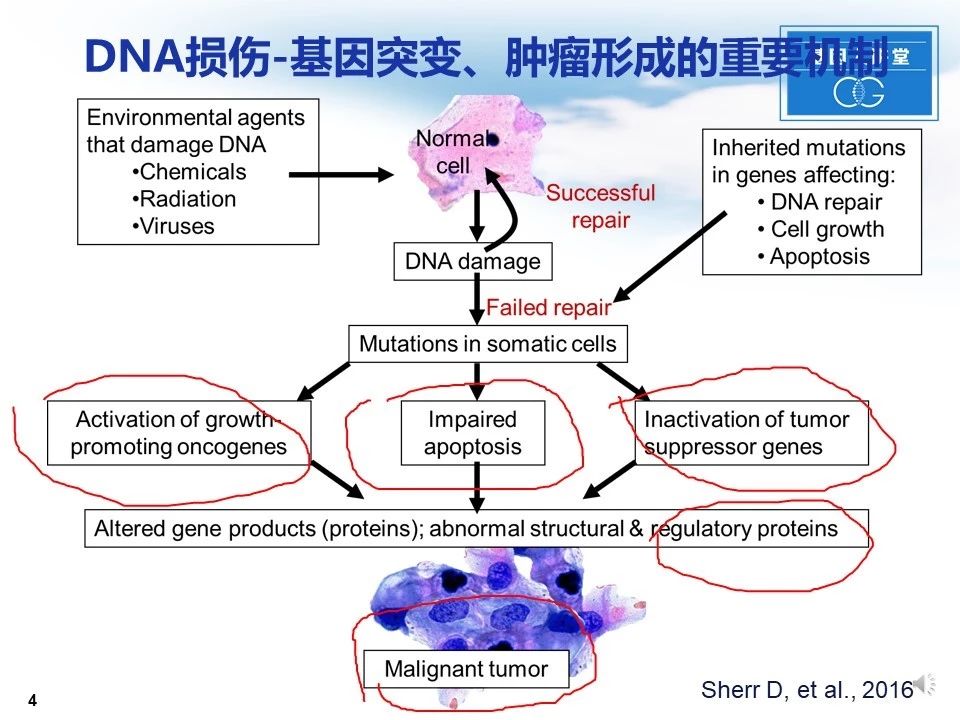
DNA损伤是基因突变、肿瘤形成的重要机制,据报道,人类80%以上肿瘤都存在着DNA修复缺陷。正常细胞,在环境与有害试剂作用下出现DNA损伤,如果损伤可逆且细胞修复机制完善,细胞成功地完成DNA修复;当细胞本身存在着某些影响细胞功能的内在突变时,细胞将不能进行有效修复,从而导致体细胞突变,随后细胞通过激活癌基因、削弱凋亡、灭活抑癌基因等途径改变蛋白表达、结构以及调节蛋白,最终导致肿瘤的发生。
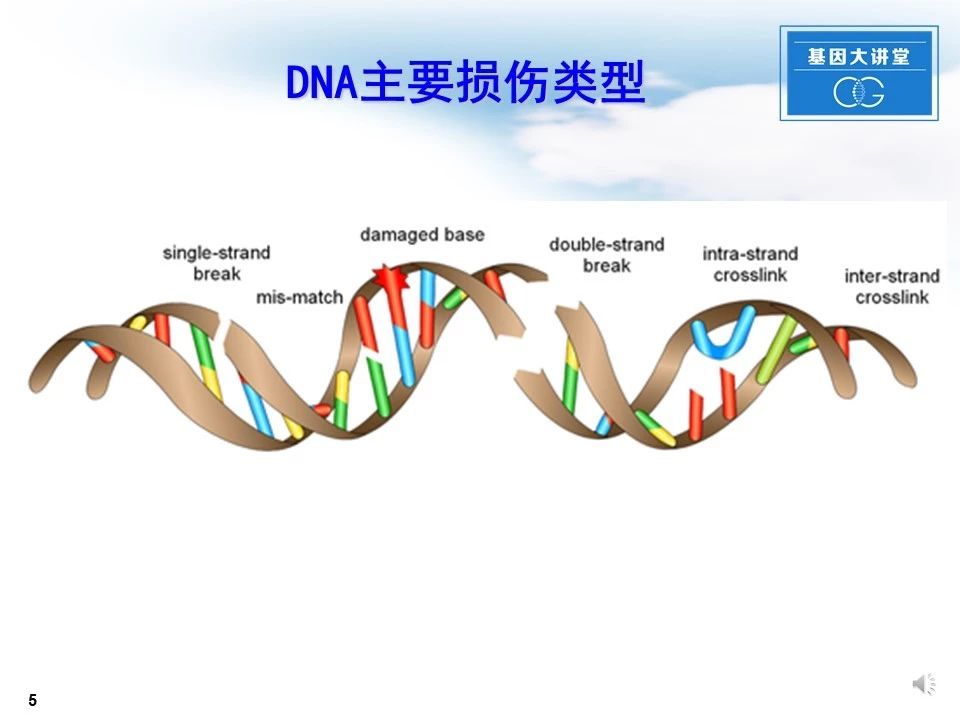
DNA在各种因素作用下,可发生单链断裂、碱基错配、碱基损伤、双链断裂、链间交联、链内交联等损伤类型。
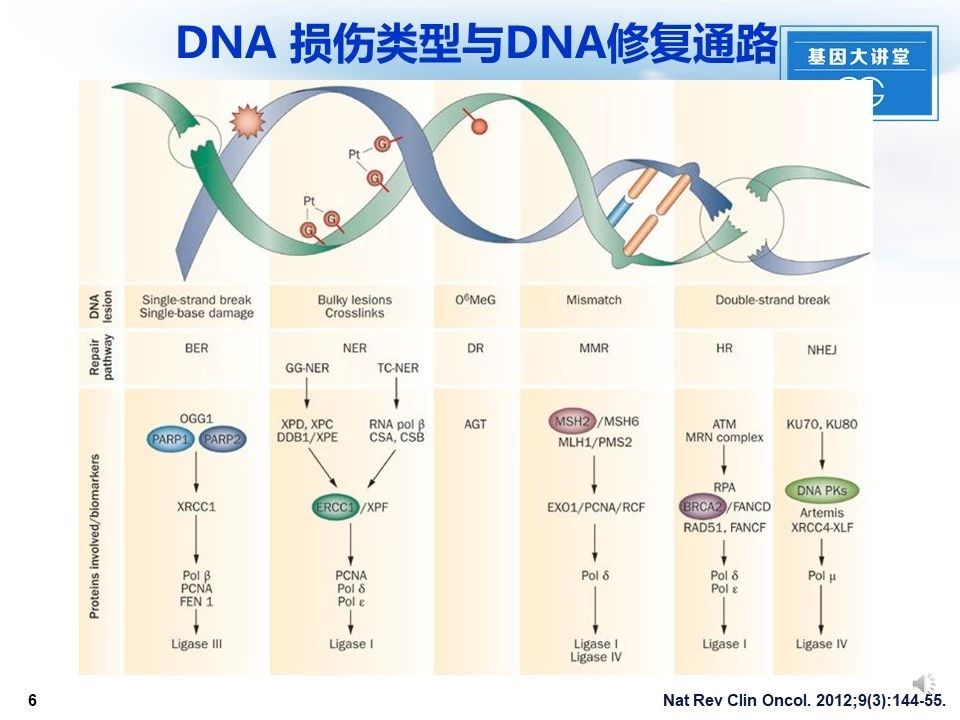
当DNA出现以上各种损伤类型,细胞将激活相应机制进行修复:如DNA出现单链断裂、单碱基损伤时,机体通过激活碱基切除进行修复;当DNA出现庞大的交联时,通过核酸切除进行修复;当出现碱基错配时,启动错配机制进行修复;出现双链断裂时,启动同源重组及非同源末端连接进行修复等。
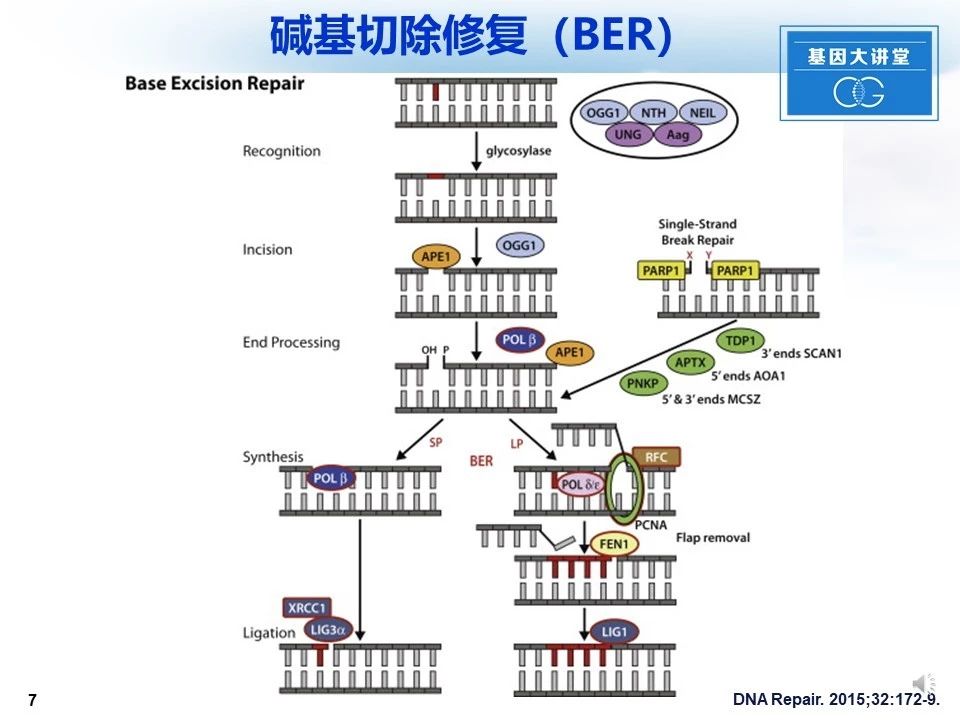
首先我们讲DNA碱基切除修复途径。碱基切除修复(BER)可以从DNA糖基化酶识别受损碱基,核酸内切酶APE1识别无嘌呤、嘧啶AP位点,或通过末端加工蛋白质识别单链断裂开始。 BER可以通加掺入单个核苷酸或通过加入两个或几个核苷酸来进行。有一些BER相关蛋白在BER起着非常重要的作用,如红色环蛋白质表示它们在小鼠中被敲除时是致命的。
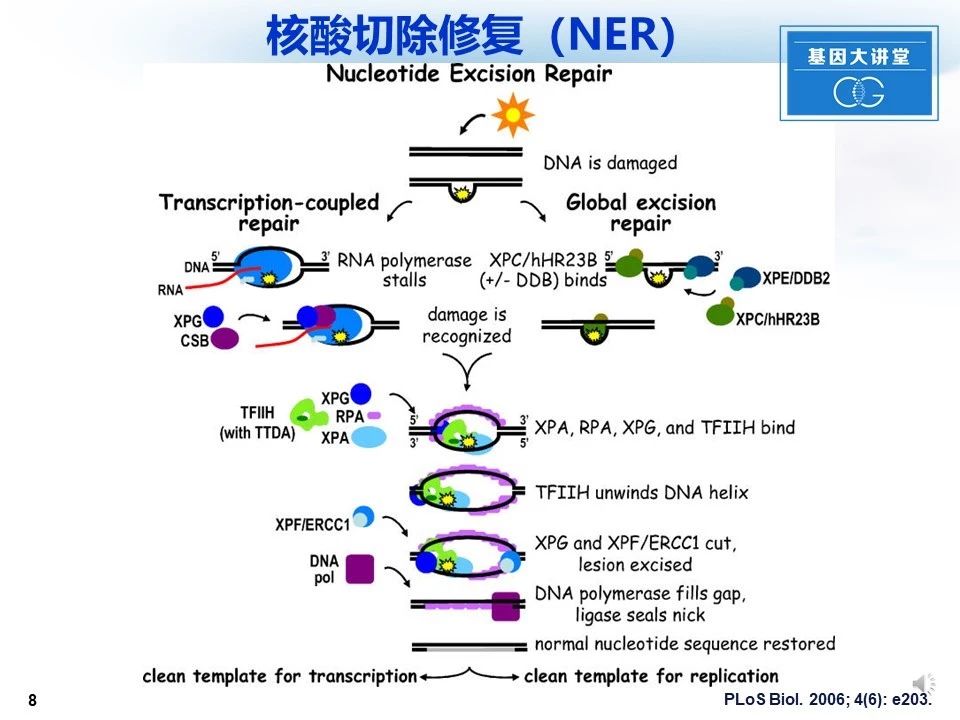
当DNA被阳光损伤时,根据DNA是否具有转录活性(转录偶联修复)或不(全局切除修复)识别损伤而不同。在初始识别步骤之后,以类似的方式修复损伤,最终结果是恢复正常核苷酸序列。
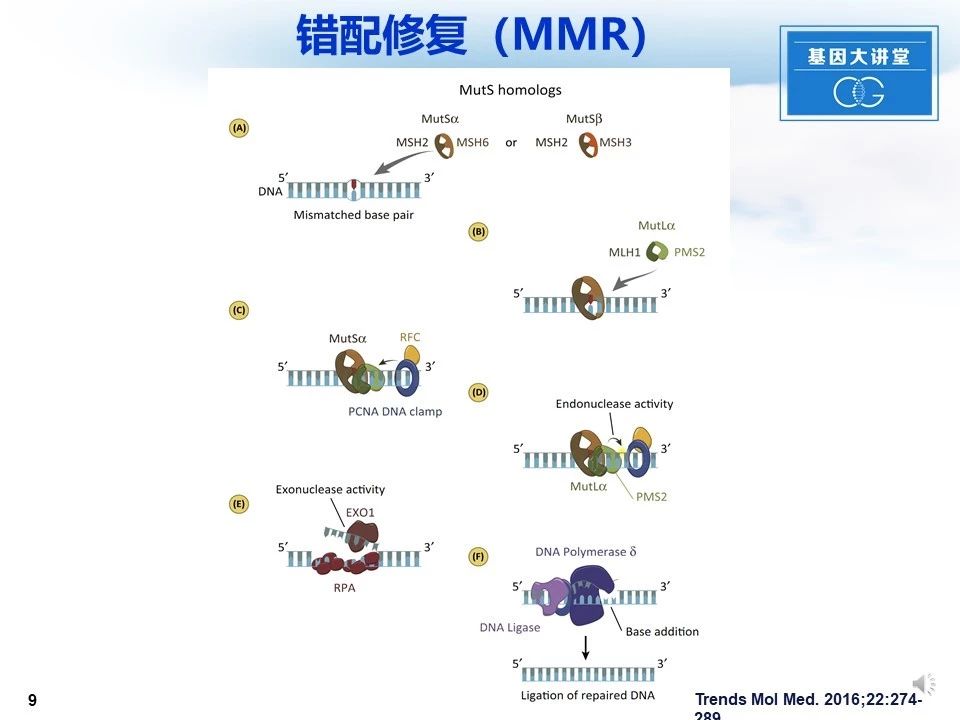
错配修复碱基错配修复途径,MMR胚系突变是Lynch综合征发生的致病因素。哺乳动物MMR的机制:首先,不匹配的DNA碱基对被MSH2-MSH6(MutSα)或MSH2-MSH3(MutSβ)识别。在错配识别后招募MLH1-PMS2(MutLα)至MutSα或MutSβ。PCNA通过RFC加载到DNA后与MutLα相互作用。PCNA-MutLα相互作用介导PMS2的内切核酸酶活性。EXO1介导错配DNA的切除。RPA与切除产生的单链RNA结合以保护该单链,并且还促进切除终止。DNA聚合酶合成新DNA以填充切除的碱基,并且新合成的链通过DNA连接酶修复。
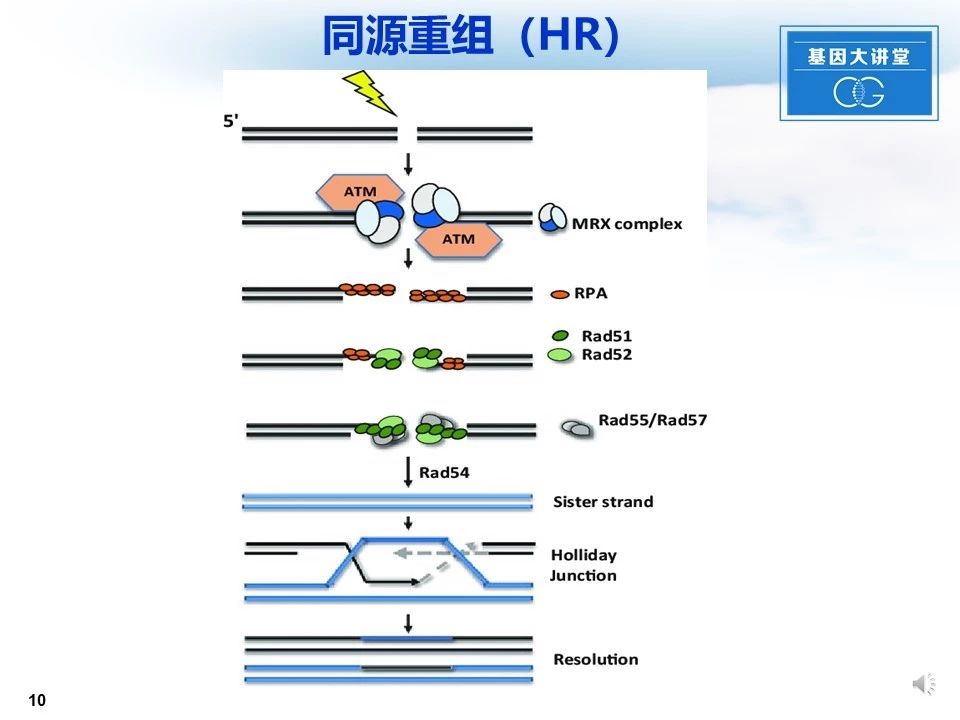
HR的分子机制:MRN复合体感受DSB并切除3‘-DNA断裂末端。然后RPA蛋白结合并稳定ssDNA。Rad52与调节物一起解除RPA并招募Rad51。然后Rad55-Rad57二聚体结合以保护和稳定Rad51核丝,并且Rad54 ATPase帮助Rad51与同源链相互作用。
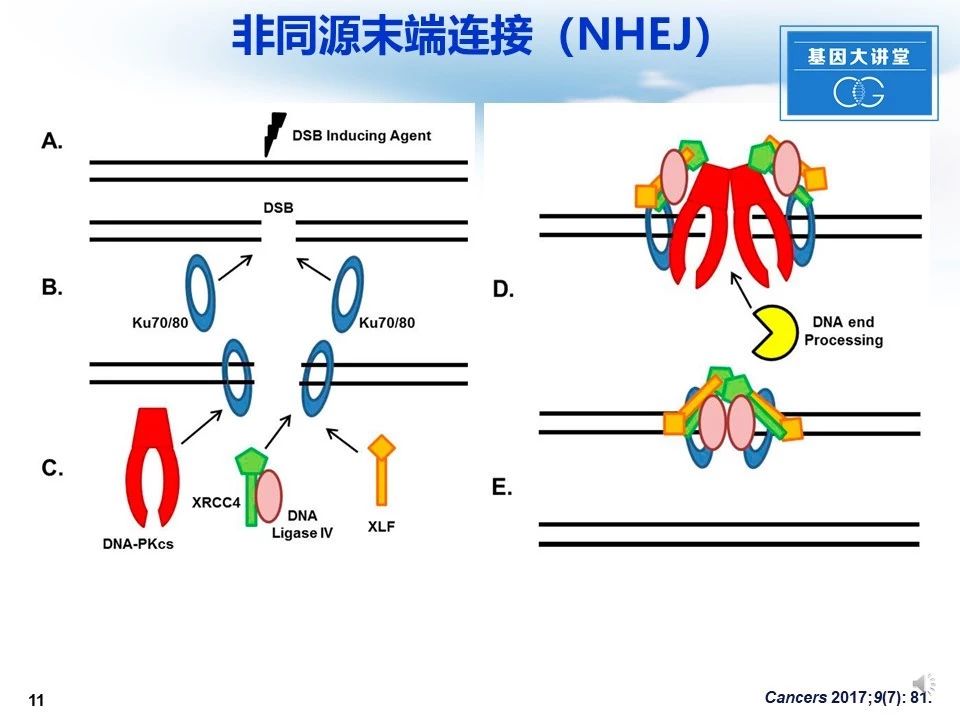
下面我们简单讨论NHEJ机制。当DNA发生双链断裂时,断裂的双链被Ku异二聚体快速结合;Ku70 / 80作为底物招募NHEJ各成员到DSB; 如果DSB末端不能连接,它们将被特定的DNA末端加工因子处理。 DSB通过DNA连接酶IV连接完成NHEJ。

接下来将介绍肿瘤DNA修复缺陷在传统化疗药物耐药中的作用。
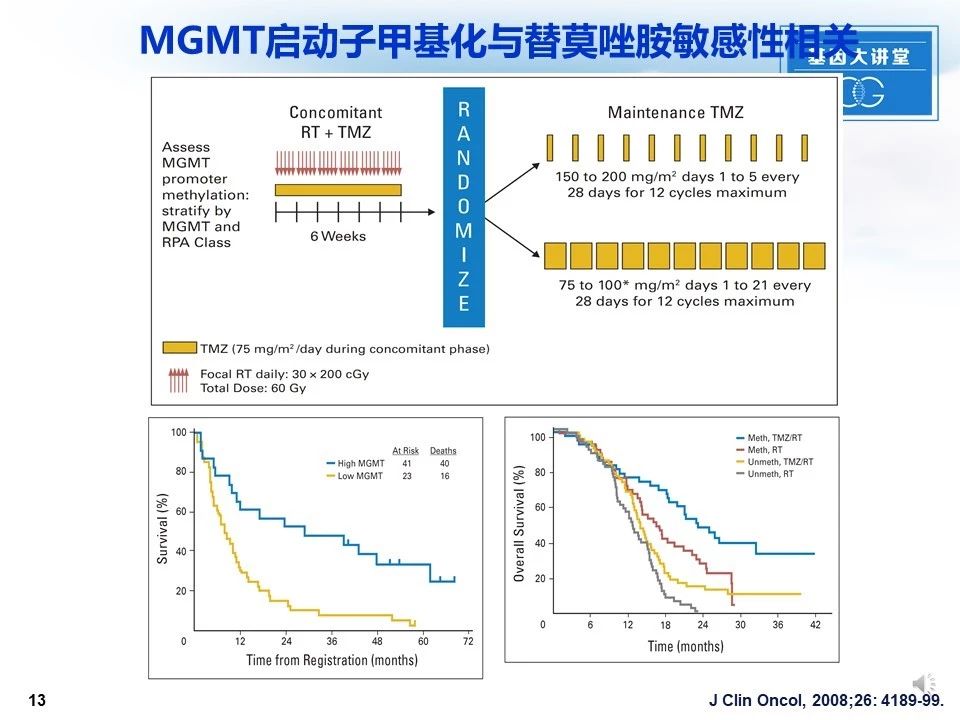
MGMT(O6-甲基鸟嘌呤-DNA-甲基转移酶)是一种可以通过去除鸟嘌呤O6位烷基基团来防止细胞DNA发生突变的一种DNA修复酶,Hegi等发现MGMT作为恶性胶质瘤化疗耐药的主要机制。他们发现Low表达MGMT与恶性胶质瘤预后不良相关,MGMT启动子甲基化预示胶质瘤患者对替莫唑胺及放疗敏感。
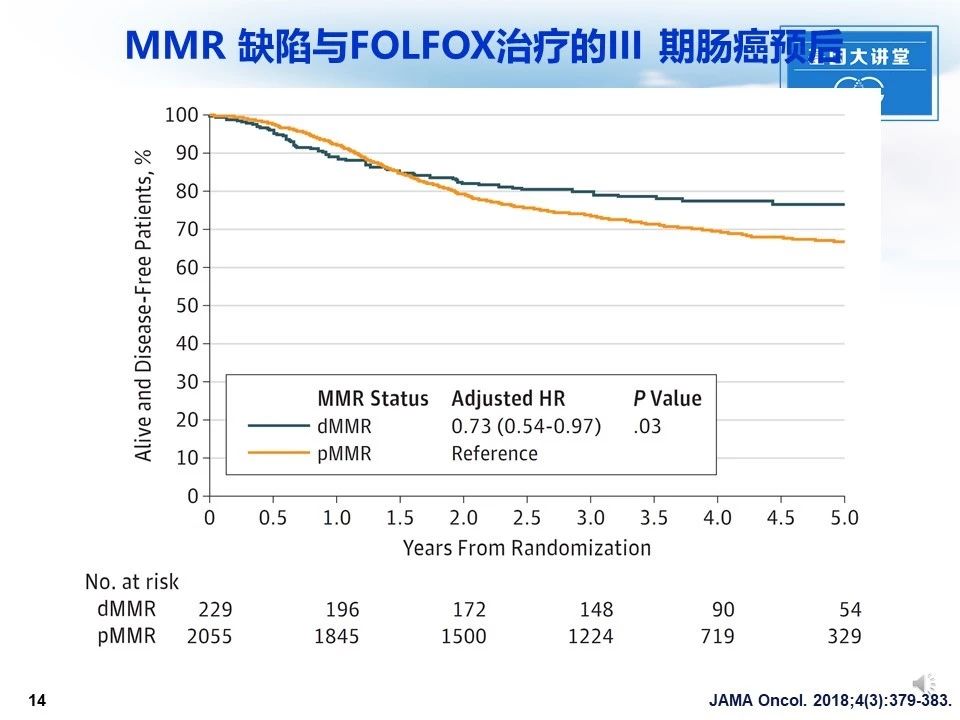
约15%结肠癌患者存在错配修复(MMR)功能的缺陷。Zaanan等研究人员收集了两个用FOLFOX(亚叶酸,氟尿嘧啶和氟尿嘧啶)治疗的结肠癌3期试验,评估患者中错配修复(MMR)表型对患者预后的影响。结果发现MMR缺陷与患者预后正好相关。
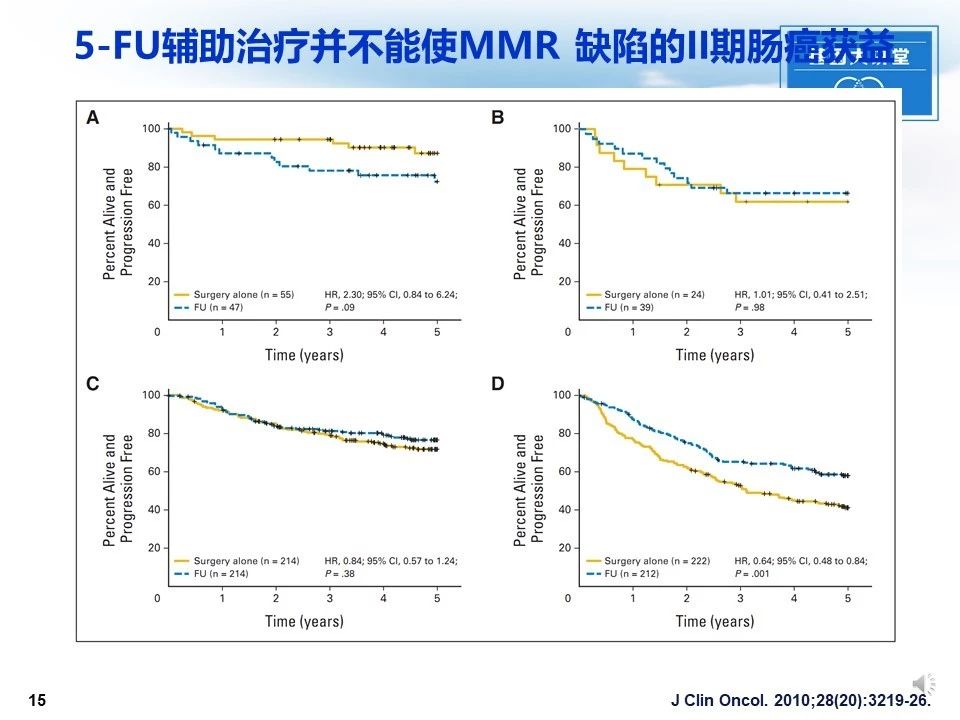
2010年著名的临床研究发现:辅助治疗显着改善了pMMR肿瘤患者的DFS;与单独手术的患者相比,接受FU的dMMR肿瘤患者的DFS没有改善;在II期的dMMR结肠癌患者中,Fu治疗与总体生存率降低相关。

机体存在多条DNA修复机制,尽管具有DNA损伤底物特异性,但却常有交叉,互为代偿。而大部分肿瘤常伴有DNA修复缺陷,因此,针对某DNA修复缺陷的补偿通路设计抑制剂具有很强的细胞杀伤效应(合成致死方式)。
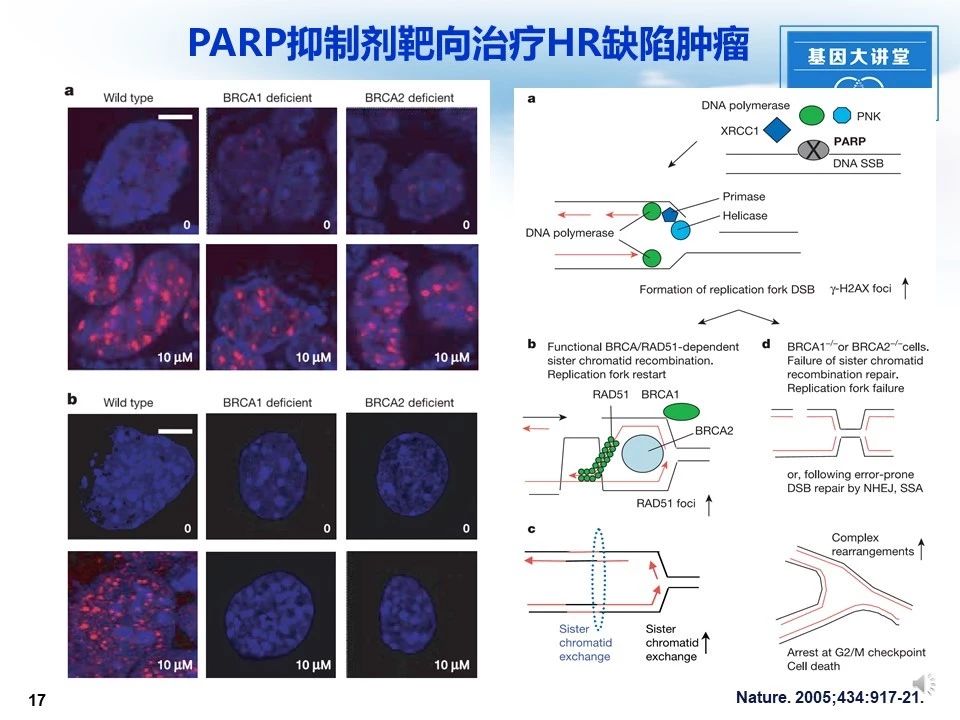
Farmer团队发现PARP抑制剂处理显著增加DNA损伤(r-H2AX foci明显增加)。为了确定这些损伤如何修复,研究者探讨了PARP抑制剂是否引起了RAD51的聚焦形成。BRCA野生型肿瘤细胞,PARP抑制剂处理增加RAD51 foci,而BRCA突变型肿瘤细胞却没发现有RAD51 foci。这些结果提示PARP抑制剂导致的DNA损伤需要涉BRCA1和BRCA2介导同源重组的机制修复。为什么BRCA1和BRCA2缺陷细胞对PARP抑制显示出极高的敏感性?PARP是碱基切除修复过程中DNA单链断裂的有效修复所必需的,并且PARP抑制导致DNA持续的单链间隙。如果复制叉遇到这些缺口,就会发生停顿并且单链间隙可能退化为DSB。通常这些DSBs可以通过RAD51依赖性同源重组来修复,BRCA1和BRCA2参与其中。在没有BRCA1或BRCA2的情况下,复制分叉无法重新启动并折叠,从而导致持久性染色体断裂。
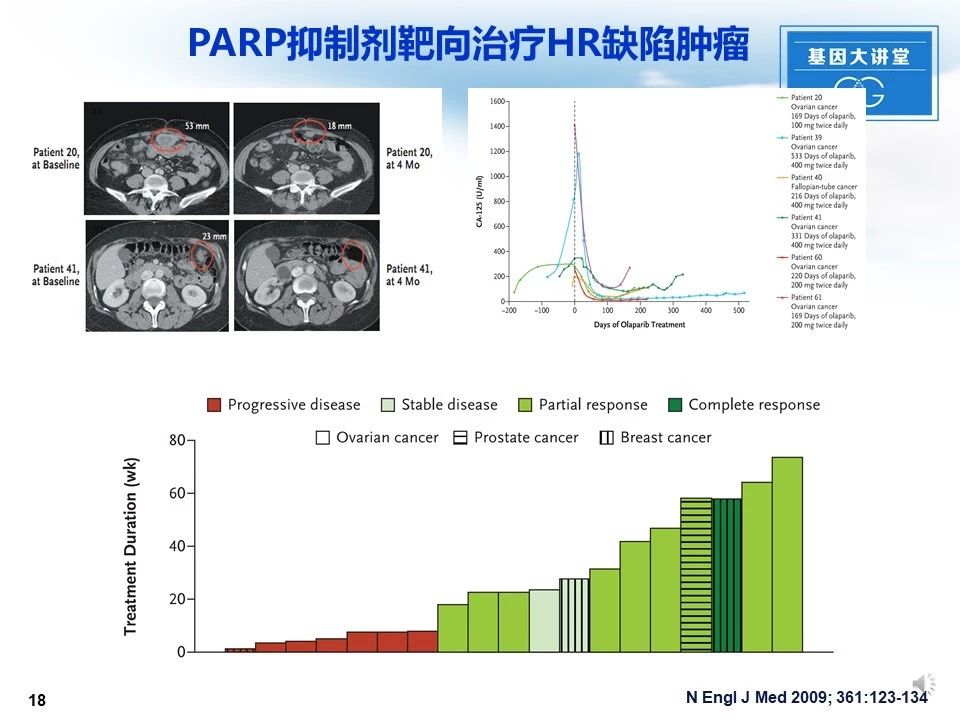
2009年6月24日,《New England Journal ofMedicine》在线发表的一项小型1期研究中显示,在23例表现BRCA1或BRCA2突变的难治性乳腺癌、卵巢癌及前列腺癌患者中,Olaparib治疗可使病变消退或稳定,而在37例与此基因突变无关的肿瘤患者中未显示任何抗肿瘤活性。
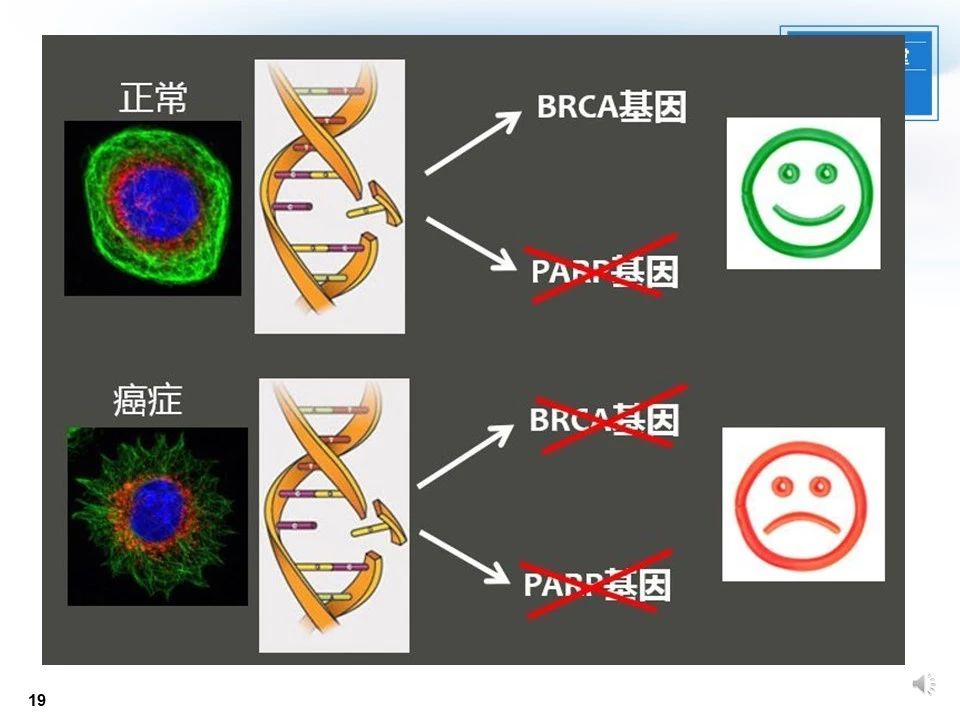
正常细胞抑制PARP酶后,细胞可通过BRCA基因进行同源重组修复;而在BRCA缺陷肿瘤细胞中,抑制PARP酶将形成协同致死性,最终导致细胞死亡。

最后我们讨论目前比较热门的话题,DNA修复缺陷在肿瘤免疫治疗中的应用。
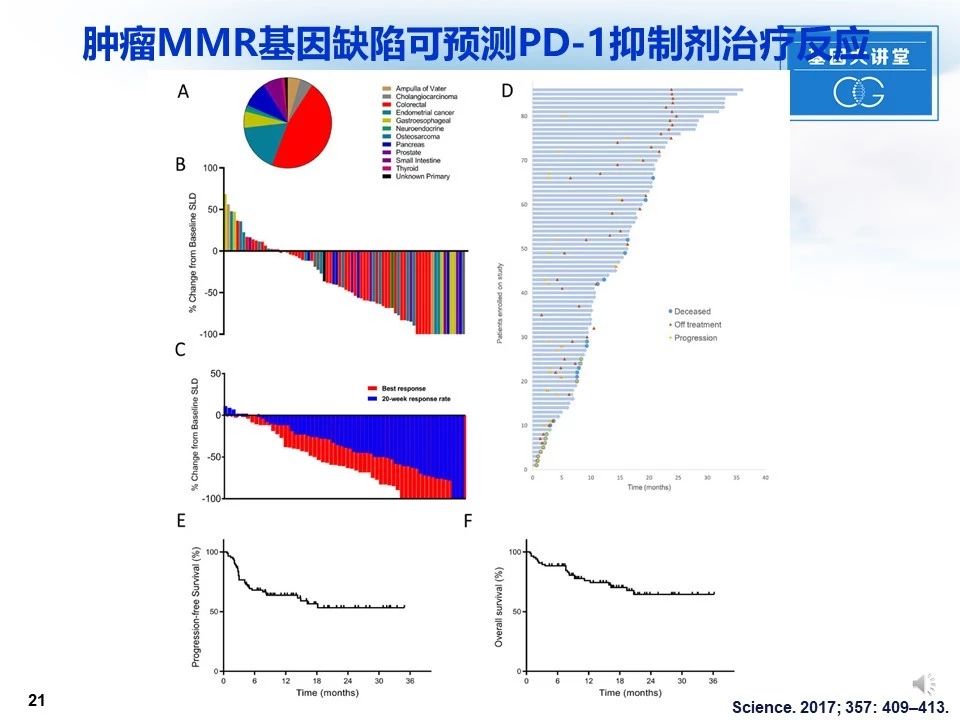
肿瘤MMR基因缺陷可预测PD-1抑制剂治疗反应。2017年science杂志公布了最新的临床研究:发现肿瘤的MMR基因缺陷可以作为预测癌症病人对PD-1抑制剂免疫疗法反应程度的临床标记物。在该研究中,研究者收集了86例经PCR或免疫组织化学证实了错配修复缺陷的一线治疗失败的肿瘤患者,并对这些病人进派姆单抗治疗,结果显示客观反应率为53%。完全缓解率达21%。

5月23日FDA官网批准了默沙东的PD-1抗体用于治疗所有携带错配修复缺陷(dMMR)的无法手术/转移实体瘤。这是FDA历史上第一次按照基因缺陷而不是发病组织批准抗癌药物,反映监管部门对肿瘤药物的新认识。

下面进行简单小结,今天我们交流了三个方面内容:DNA通过碱基切除、核酸切除、错配、同源重组、非同源末端连接等方式进行修复;DNA修复缺陷与肿瘤传统化疗耐药关系密切;DNA修复缺陷在肿瘤靶向治疗如PARP抑制剂、抗PD-1免疫治疗有重要的预测价值。

在基于DNA修复缺陷肿瘤的个体化治疗进程中,部分研究结果让人欢喜,如HR缺陷、MMR缺陷肿瘤患者有了新治疗靶点,但目前存在的问题仍很多很多,需要广大临床医师与科学家的不懈努力!
Part-3
问答环节
观众a:
感谢蔡博精彩而详实的报告,我有一个问题请教下您,在人类常见的肿瘤类型里面,有哪些常见的DNA修复相关基因突变呢?有哪些相应的潜在靶向治疗药物?
蔡木炎老师:
人类常见的DNA修复基因突变包括TP53,MMR,BRCA1,BRCA2,ATM等,针对BRCR突变的乳腺癌与卵巢癌目前用PARP抑制剂,而针对MMR缺陷肿瘤可采用抗PD-1治疗,而ATM缺陷可以尝试ATR抑制剂治疗等。
观众b:
蔡博您好,肿瘤细胞常伴有DNA修复缺陷,但为什么肿瘤细胞却比正常细胞生长更快、更有侵袭性呢?
蔡木炎老师:
这是很有趣的问题!机体正常细胞有完整的DNA损伤修复体系与细胞周期监控点机制,所以我们的基因组能够相对维持稳定。而肿瘤细胞常伴有DNA修复与细胞周期监控点方面的缺陷,肿瘤细胞常出现高度可变状态,这些突变常改变细胞的各种特性,通过细胞不断筛选进行,最终部分细胞生存下来,导致生长更快与更强的侵袭性。
观众c:
蔡老师您好,请问如何判断dMMR,请问有什么比较全的数据库吗?
蔡木炎老师:
您是指dMMR肿瘤类型数据库,还是基因list数据库呢?
观众c:
基因突变数据库。
蔡木炎老师:
如果是肿瘤的话,TCGA里就有,针对需要dMMR的基因就可以查到。TCGA可免费下载使用。
观众d:
请问老师,FDA批准PD-1抗体用于MSI-H或者dMMR类型的多种实体瘤,那么临床上如何识别这一类的肿瘤呢?
蔡木炎老师:
MSI常由MMR基因突变及功能缺失导致。因此,检测肿瘤细胞中MSI状态,可以直接检测MSI的序列变化,也可以检测MMR基因缺失来确定是否存在MSI。MMR基因缺陷检测常依赖于免疫组化(蛋白水平),而MSI检测一般依赖于分子手段如PCR检测(MSI序列改变)。当然,现在也有文献报道可以采用外显子测序方法进行MSI表型检测。但是目前临床上检测MSI状态还是MMR蛋白表达与PCR检测。


